Пример ковалентне везе
Хемија / / July 04, 2021
Тхе Ковалентна веза је онај у коме два атома се уједињују делећи своје електроне, како бисте употпунили своја правила октета.
Историја ковалентне везе
Почетком 20. века хемичари су почели да схватају како и зашто настају молекули. Прво велико откриће дошло је са предлогом Гилберт Левис о чему формирање хемијске везе подразумијева да атоми деле електроне. Левис је описивао стварање хемијске везе у водонику као:
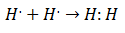
Ова врста упаривања електрона је пример ковалентне везе, везе у којој два електрона деле два атома. Тхе Ковалентна једињења Они су то садрже само ковалентне везе.
Електрони у ковалентној вези
Ради једноставности, заједнички електронски пар често се представља као једна линија повезујући симболе елемената. Тако је ковалентна веза молекула водоника записана као Х-Х.
У ковалентној вези сваки електрон заједничког пара привлаче језгра оба атома. Ова привлачност држи два атома у молекулу Х заједно.2 а одговоран је за стварање ковалентних веза у другим молекулима.
У ковалентним везама између атома неколико електрона
учествују само валентни електрони, који су најудаљенији, у плиткој орбити. Између једног и троје њих учествоваће у унији.Позивају се остали електрони који не учествују у вези Нелепљиви електрони, или ако их организујемо у паровима, Бесплатни парови. Односно, парови Валенциа Елецтронс који не учествују у формирању ковалентних веза.
Заступљеност ковалентних веза
Структуре са којима су заступљена ковалентна једињења, попут Х.2 и Ф.2 познати су као Левисове структуре. Луисова структура је а представљање ковалентне везе, где је пар заједничких електрона означени линијама или као парови тачака између два атома, а неподељени слободни парови означени су као парови тачака на појединачним атомима. У Луисовој структури приказани су само валентни електрони, а не и унутрашњи.
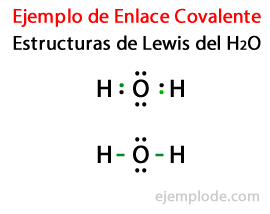
Узимајући у обзир Луисову структуру за молекул воде Х.2Или су сви валентни електрони атома водоника и кисеоника прво обележени тачкама.
У другом случају, веза је означена линијом. И бесплатни парови, који ће постојати само у кисеонику, са бодовима.
Правило октета
Стварање ових молекула, попут оних из воде Х.2Или, илуструјте позив Правило октета, који је предложио Левис: Атом који није водоник тежи стварању веза све док се не окружи осам валентних електронаОдносно, ковалентна веза настаје када нема довољно електрона за сваки поједини атом да заврши свој октет.
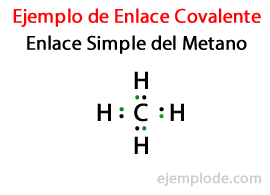
Дељењем електрона у ковалентној вези, сваки атом завршава свој октет. За водоник је захтев да добијете електронску конфигурацију хелијума, која треба да има укупно два електрона.
Правило октета углавном функционише за елементе другог периода или реда периодног система. Ови елементи имају поднивое у којима може бити укупно осам електрона.
Када атом ових елемената формира ковалентно једињење, он добија електронску конфигурацију неонског племенитог гаса, делећи електроне са другим атомима у истом једињењу.
Врсте ковалентних веза
Атоми могу формирати различите врсте ковалентних веза: Појединачно, дубл или троструко.
У а Једноставна веза, два атома су спојена помоћу Пар електрона. Јављају се у великој већини ковалентних једињења и то је најосновнији облик ове везе.
У многим једињењима, Доубле Линкс, односно када два атома деле Два пара електрона. Ако два атома деле два пара електрона, ковалентна веза се назива двострука веза. Те везе се налазе у молекулима попут угљен-диоксида (ЦО2) и етилен (Ц.2Х.4).

А. Трипле Линк настаје када два атома деле Три пара електрона, као у молекулу азота Н.2, молекул ацетилена Ц.2Х.2.

Вишеструке везе су краће од једноковалентних. Тхе Дужина везе је дефинисано као растојање између језгра два спојена атома ковалентном везом у молекулу.
Разлике између ковалентних и јонских једињења
Јонска и ковалентна једињења представљају значајне разлике у својим општим физичким својствима, услед чињенице да су њихове везе различите природе.
У Ковалентна једињења постоје две врсте привлачних сила; један од њих је онај који држи заједно атоме молекула. Квантитативна мера ове привлачности је енергија која повезује. Друга сила привлачења делује између комплетних молекула и назива се Интермолекуларна сила. Будући да су интермолекуларне силе обично слабије од сила које атоме молекула држе заједно, молекули ковалентне једињења везују се са мање силе.
Узастопно, ковалентна једињења су готово увек гасови, течности или чврсте материје који се ниско топен. С друге стране, електростатичке силе које држе јоне на окупу у јонском једињењу су обично врло јаки, тако да су јонска једињења чврста на собној температури и имају високе тачке топљења. Многа јонска једињења су растворљива у води, а њихови водени раствори проводе електричну енергију јер су та једињења снажни електролити.
Већина ковалентна једињења су нерастворљива у води, и ако се растворе, његових водених раствора као и обично не проводе струју јер су ова једињења неелектролити. Растопљена јонска једињења проводе електричну енергију јер садрже катион и анионе који се слободно крећу; течна или растопљена ковалентна једињења не проводе електричну енергију јер нису присутни јони.
Примери ковалентно везаних једињења
- Ацетилен Ц.2Х.2
- Метан ЦХ4
- Етан Ц.2Х.6
- Пропан Ц.3Х.8
- Бутан Ц.4Х.10
- Бензен Ц.6Х.6
- Толуен Ц.7Х.8
- Метил алкохол ЦХ3Ох
- Етилни алкохол Ц.2Х.5Ох
- Пропил алкохол Ц.3Х.7Ох
- Метил етар ЦХ3ОЦХ3
- Метил етил етар Ц.2Х.5ОЦХ3
- Етил етар Ц.2Х.5ОЦ2Х.5
- Мравља киселина ХЦООХ
- Сирћетна киселина ЦХ3ЦООХ
- Пропионска киселина Ц.2Х.5ЦООХ
- Маслачна киселина Ц.3Х.7ЦООХ
- Угљен-диоксид ЦО2
- Угљенмоноксид ЦО
- Молекуларни азот Н.2
- Молекуларни водоник Х.2



