Пример органске хемије
Хемија / / July 04, 2021
Тхе Органска хемија То је део Опште хемије задужен за проучавање и функционалну класификацију хемијских једињења чији је структурни елемент Угљеник, присутан у изобиљу у живе материје; Ово ствара врло диференцирани универзум неорганске хемије, посвећен хемијским једињењима класификованим као минерали.
Атом угљеника има четири електрона у последњој љусци своје електронске конфигурације. Ова карактеристика, заједно са карактеристикама атомског радијуса, омогућава јој да се ковалентним везама придружи другима атоми истог елемента, у бројним ланцима, чине велику разноликост хемијских једињења стабилно.
Можете проверити Ковалентне везе.
Таква хемијска једињења, поред атома угљеника који им дају своју исконску структуру, садрже атоме водоника као главни додатак валенцији угљеника. Поред тога, у овој разноликости једињења постоје она са интервенцијом атома кисеоника, Азот, халогени, сумпор, па чак и фосфор, земноалкални и земноалкални елементи и метали прелаз. Зависно од тога ко је укључен у молекул, то ће бити физичка и хемијска својства коначне супстанце.
Тхе органски састојци; састојци органског порекла присутни су широм живе материје; промовишу и одржавају све биолошке функције, за разлику од неорганских или минералних супстанци, које су људи користили у комерцијалне сврхе, за експерименте или за испуњавање одређених домаћих задатака.
Историја органске хемије
Пре 1828. године већ се правила разлика између органске хемије и неорганске хемије. Органска материја је повезана са стварањем кроз "витална сила", а неорганским са неживим, са минералима. С обзиром на ове концепције, није се могло очекивати да се органска једињења добијају из неорганских материјала у лабораторији.
Међутим, 1828. Фриедрицх Вохлер (1800-1882) успео да припреми органску супстанцу, Уреа ЦО (НХ2)2, важан производ метаболизма животиња, од неорганских једињења. Лечење Оловни цијанат Пб (ЦНО)2 са Амонијак НХ3 да добијем Амонијум цијанат НХ4ЦНО; Ово једињење је заиста настало, али када је раствор прокуван да би се кристализовао амонијум цијанат, трансформисан је у уреу.
Ова хемијска промена је пример Интерно прегруписавање, код којих се број или класа атома у молекулу не мења, већ само њихов поредак у њему. Ове врсте трансформација су врло честе у органској хемији.
Вохлерово откриће је касније иницирало напуштање теорије о животној снази потпуно одбачен праћен припремом многих других органских једињења у лабораторија. Упркос томе, квалификатор неорганског и органског постоји, јер су неорганска једињења сродна минералним производима а органска једињења, која су заправо једињења угљеника и водоника и њихови деривати, су врсте коју производе живи организми.
Иако се закони опште хемије једнако односе на оба једињења, различити узроци оправдавају и чине ову поделу неопходном. Дакле, органска и неорганска једињења се разликују у различитим својствима, као што су: њихова Растворљивост пожељно у органским растварачима (етар, алкохол, хлороформ, итд.), односно у води Стабилност (органска једињења се разлажу на релативно ниским температурама), а Карактер реакција; за неорганска једињења су јонска, једноставна и практично тренутна, а за органска једињења су ковалентна, сложена и спора.
Органски састојци; састојци органског порекла
Позната су једињења угљеника са ланцима до деведесет атома. Тхе ланци Атоми угљеника могу бити линеарна и разграната и имају једноструке ковалентне везе или имају двоструке или троструке везе. Познато је више од 2.500 једињења која садрже само угљеник и водоник (Угљоводоници).
Изомерија органских једињења
У неорганским једињењима, формула генерално представља једно једињење; дакле, постоји само једна супстанца формуле Х.2СВ4. Молекул сумпорне киселине садржи два атома водоника, један од сумпора и четири од кисеоника, у специфичном и јединственом распореду. У органским једињењима је ретко да се ово догоди. Тако, на пример, постоје два једињења која одговарају на формулу Ц.2Х.6Или, етилни алкохол или етанол и диметил етар.

Што је молекул сложенији, односно већи је број атома угљеника, то је већи број могућих изомера.
Анализа органских једињења
Анализа органског једињења обухвата квалитативна анализа, квантитативна анализа и Функционална анализа. У случају претпоставке да је једињење у нечистом стању, претходно је пречишћено Кристализација, Дестилација, Сублимација, Екстракцијаитд. Критеријум чистоће може се оценити на основу његових физичких константи, као што су тачка топљења, тачка кључања, густина, растворљивост, кристални облик, индекс преламања итд.
Тхе квалитативна анализа Верификује се истраживањем присуства елемената који чине једињење, посебно угљеника, водоника и азота, а понекад и халогена, сумпора и фосфора.
Тхе квантитативна анализа Изводи се на основу метода које се користе за квалитативну анализу. Полазна тачка је одређена количина супстанце која се сагорева, а угљен-диоксид се сакупља и одмерава. угљеник и водена пара формирани за израчунавање процента угљеника и водоника у једињење. Резултати квантитативне анализе олакшавају израчунавање Емпиријска формула, иако се молекуларна формула може наћи тек након одређивања молекуларне тежине супстанце. Али проблем још увек није решен, јер иста молекулска формула може одговарати различитим изомерима.
Класификација органских једињења
По својој структури органска једињења се деле на једињења алифатски, ароматичан И. хетероцикличан. Алифатска једињења су сродна метану ЦХ4, су отворени ланци, осим циклопарафина, а своје име дугују чињеници да животињске и биљне масти припадају овој групи.
Тхе ароматична једињења, затворени ланац, уско повезан са бензеном, Ц.6Х.6, а своје име дугују чињеници да многи од њих имају мирисне, пријатне мирисе.
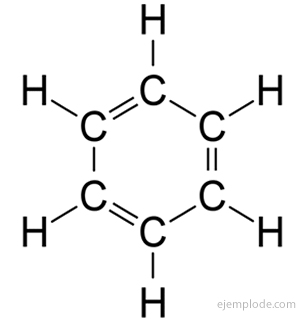
Прстен од бензена
Тхе хетероциклична једињења Они су једињења затвореног ланца у којима у прстену постоји елемент који није угљеник.
По свом уставу они су:
Угљоводоници, који је пак, због врсте веза које има, класификован као Алкани, Алкенес И. Алкини. Поред тога, у ову категорију спадају и циклоалкани, бензен и њихови деривати који се састоје само од угљеника и водоника.
Хетероциклична једињења
Халогени деривати:Р-Кс
Нитро једињења:Р-НО2
Сулфонске киселине:Р-СО3Х.
Нитрили (ИЛИ алкил цијаниди) и изонитрили:Р-ЦН и Р-НЦ. Они се разликују по томе како је атом азота везан у молекулу.
Алкохоли:Р-ОХ
Феноли: Једињења на бази окоснице која се састоји од бензенског прстена са додатом хидроксилном групом.

Етери:Р-О-Р
Меркаптани: Р-СХ
Тиоетри:Р-С-Р
Тиокиселине:Р-ЦОСХ
Алдехиди:Р-ЦХО
Кетони:Р-ЦО-Р
Карбоксилне киселине:Р-ЦООХ
Изађи:Р-ЦООМ (М за метал)
Естри: Р-ЦОО-Р
Анхидриди: Р-ЦО-О-ОЦ-Р
Амини:Р-НХ2, Р-НХ-Р, 2Р-Н-Р
Угљени хидрати типа Алдоса:-ЦХОХ-ЦХОХ-ЦХО
Угљени хидрати типа кетозе:-ЦХОХ-ЦО-ЦХ2Ох
Органометална једињења:Р-М-Р
Метал-алкил халогениди:Р-МКС (познат и као Григнард Реагенси)
