20 Exempel på syrasalter
Miscellanea / / July 04, 2021
I oorganisk kemi salter kallas föreningar som erhålls när a syra dess väteatomer ersätts av metalliska katjoner (även om ibland av icke-metalliska katjoner, t.ex. ammoniumkatjonen, NH4+). I det specifika fallet med syrasalter, är syrenas väten delvis substituerade, dvs åtminstone ett osubstituerat väte återstår som en del av saltet. Genom att de skiljer sig från neutrala salterdär syrenas väten är helt substituerade.
De du går ut bildas vanligtvis genom reaktionen mellan a syra och en hydroxid (bas). I dessa reaktioner förlorar basen normalt sina hydroxylgrupper (-OH) och syran förlorar dem. atomer väte (H), bildande ett neutralt salt; men om syran i fråga sparar åtminstone en av dess väteatomer, och ändrar reaktionens elektriska laddning, kommer vi att få ett syrasalt eller ett hydrerat salt.
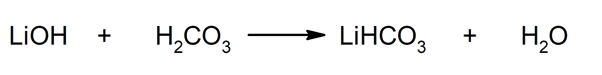
Således erhålls exempelvis litiumbikarbonat och vatten från reaktionen mellan litiumhydroxid och kolsyra:
Nomenklatur för syrasalter
Syrasalter kan namnges enligt tre typer vanligaste nomenklaturen:
Exempel på syrasalter
- Natriumbikarbonat (NaHCO3). Även kallat natriumvätekarbonat (IV), det är ett vitt kristallint fast ämne, lösligt i vatten, som kan hittas i naturen i staten mineral- eller så kan den produceras i laboratoriet. Det är en av de mest kända syrasalterna och används ofta i konfektyr, farmakologi eller yoghurttillverkning.
- Litiumvätekarbonat (LiHCO3). Detta syrasalt har använts som ett infångningsmedel för CO2 i situationer där sådan gas är oönskad, som i de nordamerikanska "Apollo" rymduppdrag.
- Kaliumdivätefosfat (KH2PO4). Det är ett kristallint fast ämne, luktfritt, lösligt i vatten och används ofta i olika industrier som jäst av mat, kelateringsmedel, näringsförstärkare och assistent vid jäsningsprocesserna.
- Natriumbisulfat (NaHSO4). Det är ett syrasalt som bildas genom neutralisering av svavelsyra. Det används ofta industriellt vid raffinering av metaller och rengöringsprodukter. Även om det är mycket giftigt för vissa tagghudingar, används det som tillsats i sällskapsdjur och vid tillverkning av smycken.
- Natriumvätesulfid (NaHS). Det är en farlig förening att hantera, eftersom den är mycket frätande och giftig. Det kan orsaka svåra hudskador och ögonskador eftersom det också är brännbart.
- Kalciumvätefosfat (CaHPO4). Det används som ett kosttillskott i spannmål för nötkreatur. Det är ett fast ämne som är olösligt i vatten men kan kristallisera när det hydratiseras genom att konsumera två molekyler av vatten.
- Ammoniumvätekarbonat ([NH4] HCO3). Även känd som "ammoniumbikarbonat", används den i livsmedelsindustrin som jäst kemiskt, även om det har nackdelen att fånga ammoniak och ge maten en dålig smak om den används i överskott. Det används också i brandsläckare, pigmenttillverkning och för att expandera gummi.
- Baribikarbonateller (Ba [HCO3]2). Det är ett syrasalt som vid uppvärmning kan vända sin produktionsreaktion och är mycket instabilt, förutom i lösning. Det används ofta i keramikindustrin.
- Natriumbisulfit (NaHSO3). Detta salt är extremt instabilt och i närvaro av syre kommer det till natriumsulfat (Na2SW4), varför det används i livsmedelsindustrin som ett livsmedelskonserveringsmedel och torkmedel. Det är ett extremt reduceringsmedel och används ofta av människor, används också för att fixera färger.
- Kalciumcitrat (AC3[C6H5ELLER7]2). Allmänt känt som bittert salt, används det som ett konserveringsmedel och som ett näringstillskott när det är kopplat till aminosyran lysin. Det är ett vitt, luktfritt, kristallint pulver.
- Monokalciumfosfat (Ca [H2PO4]2). Det är ett färglöst fast ämne som erhålls från reaktionen mellan kalciumhydroxid och fosforsyra, som ofta används som jäsmedel eller som gödningsmedel i jordbruksarbetet.
- Dikalciumfosfat (CaHPO4). Även känd som kalciummonovätefosfat, har det tre olika kristallina former som används som tillsats i livsmedel och finns i tandkräm. Dessutom bildas det naturligt i njurstenar och i den så kallade ”njurstenen”.
- Monomagnesiumfosfat (MgH4P2ELLER8). Det är ett vitt, kristallint och luktfritt salt, delvis lösligt i vatten. Det används för konservering av mat, som ett surgörande medel, som en surhetskorrigerare eller medel vid behandling av mjöl.
- Natriumdiacetat (NaH [C2H3ELLER2]2). Detta salt används som smak- och konserveringsmedel i livsmedel, vilket förhindrar eller försenar utseendet svamp och mykobakterier, både i vakuumpackade produkter såsom köttprodukter och i mjölindustrin.
- Kalciumvätekarbonat (Ca [HCO3]2). Det är ett hydrerat salt som härstammar från kalciumkarbonat, närvarande i mineraler som kalksten, marmor och andra. Denna reaktion involverar närvaron av vatten och CO2, så det kan uppstå spontant i grottor och grottor som är rika på kalcium.
- Rubidiumsyrafluorid (RbHF). Detta salt erhålls från reaktionen mellan fluorvätesyra (väte och fluor) och rubidium, en alkalimetall. Resultatet är en giftig och frätande förening som måste hanteras med försiktighet.
- Monoammoniumfosfat ([NH4] H2PO4). Det är ett vattenlösligt salt som produceras genom reaktion mellan ammoniak och fosforsyra. Det används vanligtvis som gödningsmedel eftersom det ger jorden den näringsämnen kväve och fosfor som är nödvändiga för växttillväxt. Det är också en del av ABC-pulvret i brandsläckare.
- Zinkväteortoborat (Zn [HBO3]). Det är ett salt som används som ett antiseptiskt medel och som tillsatsmedel vid tillverkning av keramik.
- Mononatriumfosfat (NaH2PO4). Det används främst i laboratorier, som en "buffert" eller buffertlösning, som förhindrar plötsliga förändringar i pH i en lösning.
- Kaliumväteftalat (KHP). Även kallat "kaliumsyraftalat", det är ett fast och stabilt salt i vanlig luft, varför det ofta används som en primär standard vid mätningar av pH. Det är också användbart som buffertmedel i kemiska reaktioner.
Följ med:


