Daltons lagexempel
Kemi / / July 04, 2021
Den engelska forskaren John Dalton (1766-1844) var en fysiker och kemist som gjorde många bidrag till kompression och klassificering av grundämnen och kemikalier. Bland hans viktigaste bidrag är den första modellen för representation av atomer och föreningar genom en grafisk representation. Han formulerade också den så kallade "Law of Multiple Proportions", även känd som Daltons lag.
På kemiska kombinationer formulerade Louis Proust (1754-1826) "Lagen med konstanta proportioner", där han samlar observationen att kemikalier alltid kombineras i samma proportion för att producera samma föreningar. Det vill säga, om väte och syre kombineras, kommer de alltid att kombineras i samma proportioner för att producera vatten. Men denna lag förklarade inte hur det fanns olika föreningar som består av samma ämnen.
Med sin atomteori insåg Dalton att när vissa enkla ämnen kombineras, kan de olika föreningar produceras och att mängden av ett av ämnena varierar i en proportionerlig proportion enkel.
Daltons lag anges så här:
Vikten av ett element som sammanfogar med samma mängd av ett annat för att bilda olika kemiska föreningar varierar beroende på ett mycket enkelt förhållande.Det betyder att om vi vet hur ämnen kombineras i enkla proportioner, och mängden av en av substanserna förblir konstant och en annan ämne vi sätter i en enkel proportion, i förhållandet 2, 3 eller 4 i förhållande till den ursprungliga andelen, i varje fall kommer vi att få ett ämne annorlunda. Detta händer till exempel när man kombinerar fosfor, väte och syre.
Om vi kombinerar 1 volym fosfor, 3 volymer väte och 2 volymer syre, får vi hypofosforsyra:
P + 3H + 2O -> PO2H3
Om vi i föregående reaktion bara varierar syret i en enkel andel av 2, får vi fosforsyra:
P + 3H + 4O -> PO4H3
Man måste ta hänsyn till att begreppet atomvalens vid denna tidpunkt ännu inte var känt det var inte känt exakt varför vissa ämnen kunde kombineras i olika proportioner och andra inte.
Daltons lagexempel
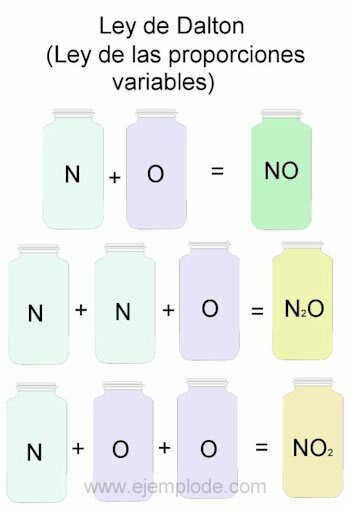
För att exemplifiera Daltons lag tar vi som referens kombinationerna av kväve (N) och syre (O).
När de kombineras i samma proportion, det vill säga en efter en, får vi kväveoxid:
N + O -> NEJ
Om vi håller kvävevolymen konstant och varierar syret med 2, får vi kväveperoxid:
N + 2O -> NEJ2
Om vi på basis av kväveoxid nu håller syre konstanta och varierar kvävevolymen med 2, får vi dikväveoxid:
2N + O -> N2ELLER
Om artikeln var användbar för dig, glöm inte att ge oss en +1.
