Exempel på peptidbindning
Kemi / / July 04, 2021
De Peptidbindning är den där två aminosyramolekyler förenas genom kondens.
För att bättre förstå peptidbindningar måste aminosyror först definieras:
De Aminosyror är organiska molekyler kort innehållande åtminstone en aminogrupp (-NH2), alkalisk till sin natur, och en karboxylgrupp (-COOH), sur karaktär.
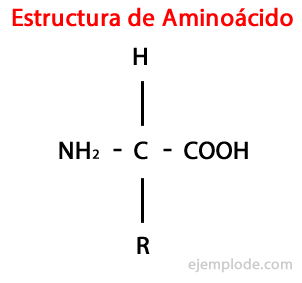
Även om levande varelser för olika ändamål syntetiserar mycket olika typer av aminosyror, är de viktigaste de som är en del av proteiner, som alla tillhör klassen av a-aminosyror.
Α-aminosyrorna kännetecknas av att syran och aminogrupperna är bundna till samma kolatom, kallad α-kol. Vidare binder detta a-kol som en tredje substituent en väteatom och som en fjärde substituent, en ytterligare grupp med olika storlek och egenskaper, som skiljer varje aminosyra från andra.
Den fjärde substituenten kallas Sidokedja Aminosyra och representeras ofta i förenklad form av bokstaven R.
Eftersom de fyra substituenterna av a-kolet är olika och antar ett tetraedriskt arrangemang runt det, finns de a-aminosyror som finns
optisk isomerism, vilket är när en molekyl har en alternativ form det ser ut som en spegelbild hans, som i slutändan inte är en lika molekyl. Dessa två isomera former av molekylen tilldelas bokstäverna D eller L, beroende på hur substituenterna är ordnade i rymden. Alla aminosyror som finns i proteiner är L.Aminosyror klassificeras enligt deras kemiska karaktär i Polar och Apolar. Polarna är i sin tur uppdelade i Neutral och laddad (som kan vara sura eller basiska). De Icke-polär kan vara alifatisk eller aromatisk.
Peptider och Peptidbindningen
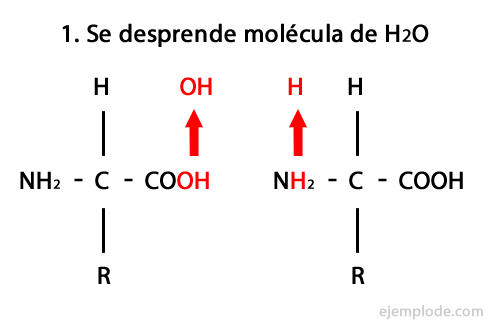
Peptider är produkten av den kovalenta föreningen av aminosyror genom amidbindningar, bildande av kondensation av karboxyländen på den ena och aminoänden på den andra, vilket frigör en vattenmolekyl i reaktion. Denna union heter Peptide Bond.
Mekanismen för denna reaktion presenteras nedan, där Amino- och karboxylgrupper, och kondensationen av aminosyramolekylerna sker för att bilda peptiden.
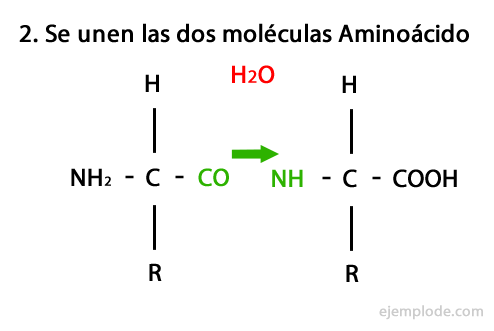

Peptider, som aminosyror och proteiner, har en aminogrupp och en karboxylgrupp i sina ändar utan att reagera.
För att specificera formeln för en enkel peptid, och till och med ett protein, räcker det att lista de aminosyror som utgör den, börjar med den med en gratis Amino-gruppoch slutar med den med dess fria karboxylgrupp.
Några peptider som finns i kroppen är Vasopressin, vilket höjer blodtrycket och ökar vattenåterupptaget i njuren; de Enkefalin, vilket minskar känslan av smärta; och den Oxytocin, vilket får livmodern att dra ihop sig.
Peptidbindningsegenskaper
Kondensationen av aminogruppen i en aminosyra med karboxylen i en annan, sker i vattenhaltigt lösningsmedel, så att det är inte spontantoch därför kräver proteinsyntes en tillförsel av energi.
Peptidbindningen, som i alla amidbindningar, presenterar resonans mellan två extrema former: den neutrala formen, med en enkelbindning som förenar karbonylkolet i den första aminosyran och aminokvävet i den andra (C-N), och formuläret med separering av avgifter där de två atomerna är länkade med en dubbelbindning (C = N). I verkligheten antar peptidbindningen inte någon av de två extrema situationerna utan är en resonanshybrid av båda.
Det är samtalet Peptidplan, bestående av alla atomerna som är involverade i peptidbindningen, som förenar de två initiala aminosyrorna. Å ena sidan kväve- och väteatomerna med deras respektive kol α i den första aminosyran. Å andra sidan, kolet α i den andra aminosyran, med syre och kol i karbonylgruppen.
Skillnader mellan peptider och proteiner
De peptider har ett lågt antal aminosyror, som sträcker sig från två till några dussin av dem, och deras konformation i lösning blir flexibel.
De små proteiner, strukturellt nära stora peptider, har en definierad konformation och mycket mindre flexibel.
Det finns proteiner som, liksom peptider, har en störd och flexibel konformation, men som ordnar när de interagerar med andra makromolekyler i cellen.
20 exempel på aminosyror som deltar i peptidbindning
- Blåregn
- Till flickan
- Valine
- Leucin
- Isoleucin
- Proline
- Metionin
- Fenylalanin
- Tyrosin
- Tryptofan
- Serine
- Treonin
- Cystein
- Sparris
- Glutamin
- Asparaginsyra
- Glutaminsyra
- Lysin
- Arginin
- Histidin



