Exempel på aromatiska föreningar
Kemi / / July 04, 2021
Kemister har funnit det användbart att dela upp alla organiska föreningar i två breda klasser: föreningar Alifatisk och föreningar Aromater. Aromatiska föreningar är bensen och föreningar med liknande kemiskt beteende. De aromatiska egenskaperna skiljer bensen från alifatiska kolväten. Bensenmolekylen är en ring av en viss typ. Det finns andra föreningar, även ringformade, som verkar skilja sig strukturellt från bensen och ändå beter sig på liknande sätt.
Det visar sig att dessa andra föreningar liknar bensen i sin grundläggande elektroniska struktur, varför de också beter sig som aromater.
Alifatiska kolväten (alkaner, alkener, alkyner och deras cykliska analoger) reagerar huvudsakligen med tillägg, i flera länkar, och av fri radikalsubstitutionvid andra punkter i den alifatiska kedjan.
Å andra sidan, aromatiska kolväten, betonas att de har en tendens att heterolytisk substitution. Vidare är samma substitutionsreaktioner karakteristiska för aromatiska ringar var de än förekommer, oavsett vilka andra funktionella grupper molekylen kan innehålla. Dessa senare grupper påverkar reaktiviteten hos aromatiska ringar och vice versa.
Bensenmolekylen
Bensen har varit känt sedan 1825, och dess kemiska och fysiska egenskaper är bättre kända än för någon annan organisk förening. Trots detta var det först 1931 som en tillfredsställande struktur föreslogs för detta ämnet, och det tog upp till 15 år innan det var i allmän användning bland kemikalier organisk. Svårigheten låg i de begränsningar av utvecklingen som strukturteorin hade nått då. Den slutliga strukturen har uppnåtts genom att anta flera viktiga fakta:
Bensen har molekylformeln C6H6. På grund av dess elementära sammansättning och molekylvikt var bensen känd för att ha sex kol- och sex väteatomer. Problemet var att känna till arrangemanget av sådana atomer.
År 1858 föreslog August Kekulé att kolatomer kan kopplas ihop för att bilda kedjor. Senare, 1865, erbjöd han ett svar på bensenproblemet: dessa karbonatkedjor kan ibland stängas för att bilda ringar.
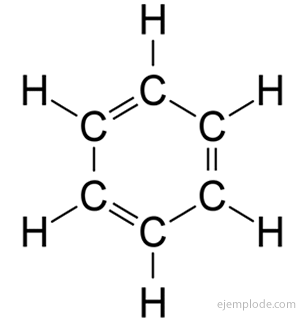
Bensen ger endast en monosubstituerad produkt C6H5Y. Till exempel, när en väteatom ersätts med brom, erhålls endast en enda konfiguration av BromoBensen C.6H5Br; analogt erhålls också en klorbensen C6H5Cl eller en NitroBensen C6H5INTE2, etc. Detta faktum innebär en allvarlig begränsning av strukturen av bensen: hela dess väte måste vara exakt motsvarande, det vill säga, de måste alla förenas med kol som i sin tur alla är lika länkad. Det kan inte finnas några väten i CH3och andra i CH2och andra i CH. Den slutliga strukturen för den monosubstituerade bör vara densamma för substitution av vätgas i bensen.
Bensen ger tre isomera disubstituerade produkter, C6H4Y2 eller C6H4OCH Z. Det finns bara tre isomera DiBromoBenzenes, C6H4Br2, tre ChloroNitroBenzenes C6H4ClNO2, etc. Detta faktum begränsar ytterligare de strukturella möjligheterna.
Bensen genomgår substitutionsreaktioner snarare än additionsreaktioner. Kekulés bensenstruktur motsvarar en som vi skulle kalla cyklohexatrien. På grund av detta bör det lätt reagera genom tillsats, liksom liknande föreningar, cyklohexadien och cyklohexen, vilket är ett kännetecken för alkenstrukturen. Men så är inte fallet; under förhållanden där alkener reagerar snabbt, reagerar inte bensen eller bara mycket långsamt. Istället för tillsatsreaktioner genomgår bensen lätt en uppsättning reaktioner, som alla är utbyte, som den Nitrering, den Sulfonering, den Halogenering, den Friedel-Crafts-alkylering, den Acylering från Friedel-Crafts. I var och en av dessa reaktioner har en atom eller grupp ersatts med en av väteatomerna i bensen.
Stabiliteten hos bensen beror på de alternerande dubbelbindningarna och även på resonansenergin, i den där dubbelbindningarna ändrar position mellan kolerna och bibehåller samma växling strukturell. Är resonansstabiliseringsenergi ansvarar för den uppsättning egenskaper som kallas Aromatiska egenskaper.
En tillsatsreaktion förvandlar en alken till en mer stabil mättad förening. Men när det gäller bensen gör en tillsats det mindre stabilt genom att förstöra ringsystemet som upprätthålls och stabiliseras genom resonans. Den slutliga molekylen skulle vara cyklohexadien. Det är på grund av detta faktum att bensenens stabilitet leder till endast substitutionsreaktioner.
Egenskaper hos aromatiska föreningar
Förutom ämnen som innehåller bensenringar finns det många andra som anses vara aromatiska, även om de på ytan knappast liknar bensen.
Ur experimentell synvinkel är aromatiska föreningar ämnen vars molekylformler antyder a hög grad av omättnad, trots vilka de är resistent mot additionsreaktioner så karakteristisk för omättade föreningar.
Istället är dessa aromatiska föreningar a genomgår ofta elektrofila substitutionsreaktioner liknar de av bensen. Tillsammans med detta motstånd mot tillägg, och förmodligen på grund av det, finns det bevis för en ovanlig stabilitet, såsom låga värmer för hydrogenering och förbränning.
Aromatiska ämnen är cykliska, som vanligtvis presenterar ringar om fem, sex och sju atomer, och deras fysiska undersökning visar att de har platta eller nästan platta molekyler. Dess protoner har samma typ av kemisk förskjutning i kärnmagnetresonansspektra som i bensen och dess derivat.
Ur teoretisk synvinkel måste en molekyl ha ett cykliskt moln av avlokaliserade π-elektroner över och under molekylens plan för att en substans ska vara aromatisk. Dessutom måste dessa π moln innehålla totalt (4n + 2) π elektroner; detta innebär att avlokalisering inte räcker för att den speciella stabilitet som kännetecknar en aromatisk förening ska resultera.
Nomenklatur för bensenderivat (aromatiska föreningar)
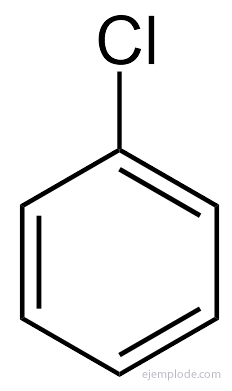
När det gäller många av dessa derivat, särskilt i de monosubstituerade, är det tillräckligt att förbereda namnet på substituentgrupp för ordet bensen, såsom exempelvis klorbensen, brombensen, jodbenzen, Nitrobensen.
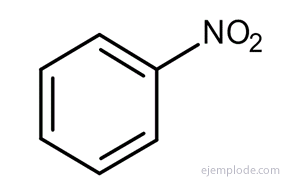
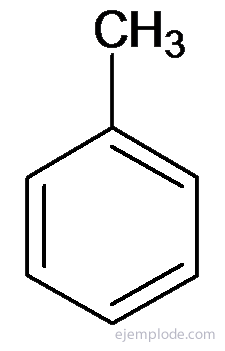
Andra derivat har speciella namn som kan sakna likhet med namnet på substituentgruppen. Exempelvis är metylbensen endast känd som toluen; AminoBensen som anilin; Hydroxibensen som fenol, etc.
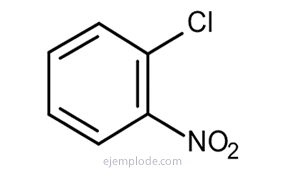
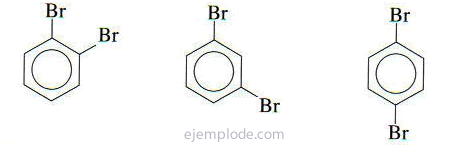
Om det finns två grupper kopplade till bensenringen är det inte bara nödvändigt att identifiera vad de är utan också att ange deras relativa plats. De tre möjliga isomererna för disubstituerade bensener kännetecknas av prefixen orto, meta och para, förkortat o-, m-, p-. Till exempel: o-DiBromoBensen, m-DiBromoBensen, p-DiBromoBensen.
Om en av de två grupperna är av den typ som ger molekylen ett speciellt namn, heter föreningen som ett derivat av den speciella substansen. Till exempel: NitroToluen, bromfenol, etc.
Exempel på aromatiska föreningar
Toluen eller metylbensen
Etylbensen
Isopropylbensen
TriNitroToluene eller TNT
Anilin eller Aminobensen
Bensoesyra
Glutaminsyra eller ParaAminoBensoesyra
Toluensulfonsyra
Fenol eller hydroxibensen
Bromfenol
Triklorbensen
Bensenfenyleter
Jodbensen
Bromo bensen
