Organisk kemi Exempel
Kemi / / July 04, 2021
De Organisk kemi Det är den del av allmän kemi som ansvarar för studien och den funktionella klassificeringen av kemiska föreningar vars strukturella element är Kol, närvarande i överflöd i levande materia; Detta skapar ett mycket differentierat universum av oorganisk kemi, dedikerat till kemiska föreningar klassificerade som mineraler.
Kolatomen har fyra elektroner i det sista skalet av sin elektroniska konfiguration. Denna egenskap, tillsammans med den hos dess atomradie, gör att den kan förenas med kovalenta bindningar till andra atomer av samma element, i många kedjor, som bildar en stor mångfald av kemiska föreningar stabil.
Du kan kolla Kovalenta bindningar.
Sådana kemiska föreningar, förutom kolatomerna som ger dem sin urstruktur, innehåller väteatomer som det viktigaste komplementet för kolvalensen. Dessutom finns det i denna mångfald av föreningar de med ingripande av syreatomer, Kväve, halogener, svavel och till och med fosfor, alkaliska och jordalkaliska element och metaller av övergång. Beroende på vem som är involverad i molekylen kommer det att vara den slutliga substansens fysikaliska och kemiska egenskaper.
De organiska föreningar är närvarande i hela levande materia; främja och upprätthålla alla biologiska funktioner, till skillnad från oorganiska eller mineralämnen, som har använts av människor för kommersiella ändamål, för experiment eller för att utföra vissa inhemska uppgifter.
Historia för organisk kemi
Före 1828 skilde man redan mellan organisk kemi och oorganisk kemi. Organisk materia var associerad med en skapelse genom a "vital kraft"och till det oorganiska med det icke-levande, med mineralet. Med tanke på dessa uppfattningar kunde man inte förvänta sig att få organiska föreningar från oorganiska material i laboratoriet.
I alla fall, 1828 Friedrich Wöhler (1800-1882) lyckades bereda en organisk substans, Urea CO (NH2)2, en viktig produkt av djurmetabolism, från oorganiska föreningar. Behandling Lead Cyanate Pb (CNO)2 med Ammoniak NH3 att få Ammoniumcyanat NH4CNO; Denna förening bildades verkligen, men när lösningen kokades för att kristallisera ammoniumcyanatet, transformerades den till urea.
Denna kemiska förändring är ett exempel på Intern omgruppering, där antalet eller klassen av atomer i molekylen inte förändras utan bara deras ordning inom den. Dessa typer av transformationer är mycket vanliga inom organisk kemi.
Wöhlers upptäckt initierade senare övergivandet av livskraftsteorin kasseras helt genom att följas av beredningen av många andra organiska föreningar i laboratorium. Trots detta består kvalificeringarna av oorganisk och organisk, eftersom oorganiska föreningar är relaterade till mineralprodukter och organiska föreningar, som faktiskt är föreningar av kol och väte och deras derivat, är av den typ som produceras av levande organismer.
Även om lagarna för allmän kemi gäller lika för båda föreningarna, berättigar olika orsaker och gör denna uppdelning nödvändig. Således skiljer sig organiska och oorganiska föreningar i olika egenskaper, såsom: deras Löslighet föredragna i organiska lösningsmedel (eter, alkohol, kloroform, etc.) respektive i vatten, dess Stabilitet (organiska föreningar sönderdelas vid relativt låga temperaturer) och Reaktionernas karaktär; för oorganiska föreningar är de joniska, enkla och praktiskt taget momentana, och för organiska föreningar är de kovalenta, komplexa och långsamma.
Organiska föreningar
Kolföreningar med kedjor på upp till nittio atomer är kända. De kedjor Kolatomer kan vara linjär och grenad och har enkla kovalenta bindningar eller har dubbla eller trippelbindningar. Mer än 2500 föreningar är kända för att endast innehålla kol och väte (Kolväten).
Isomerism av organiska föreningar
I oorganiska föreningar representerar en formel vanligtvis en enda förening; sålunda finns det bara en substans med formeln H2SW4. Svavelsyramolekylen innehåller två väteatomer, en av svavel och fyra av syre, i ett specifikt och unikt arrangemang. I organiska föreningar är det sällsynt att detta händer. Således finns det exempelvis två föreningar som svarar på formeln C2H6Eller etylalkohol eller etanol och dimetyleter.

Ju mer komplex molekylen, det vill säga ju större antal kolatomer, desto större antal möjliga isomerer.
Organisk föreningsanalys
Analysen av en organisk förening innefattar kvalitativ analys, den kvantitativ analys och den Funktionsanalys. I fallet att man antar att föreningen är i orent tillstånd renas den tidigare av Kristallisering, Destillering, Sublimering, Extraktion, etc. Renhetskriteriet kan bedömas utifrån dess fysiska konstanter, såsom smältpunkt, kokpunkt, densitet, löslighet, kristallin form, brytningsindex, etc.
De kvalitativ analys Det verifieras genom att undersöka närvaron av elementen som utgör föreningen, särskilt kol, väte och kväve, och ibland halogener, svavel och fosfor.
De kvantitativ analys Det utförs med hjälp av de metoder som används för kvalitativ analys. Utgångspunkten är en viss mängd ämne som genomgår förbränning och koldioxiden samlas upp och vägs. bildat kol och vattenånga för att beräkna andelen kol och väte i förening. Resultaten av den kvantitativa analysen underlättar beräkningen av empirisk formel, även om molekylformeln endast kan hittas efter bestämningen av ämnets molekylvikt. Men problemet är ännu inte löst, eftersom samma molekylformel kan motsvara olika isomerer.
Klassificering av organiska föreningar
Enligt deras struktur är organiska föreningar uppdelade i föreningar alifatisk, aromatisk Y heterocyklisk. Alifatiska föreningar är relaterade till metan CH4, är öppna kedjor, förutom cykloparaffiner, och är skyldiga deras namn till det faktum att animaliska och vegetabiliska fetter tillhör denna grupp.
De aromatiska föreningar, sluten kedja, nära besläktad med bensen, C6H6, och de är skyldiga sitt namn till det faktum att många av dem har doftande, behagliga dofter.
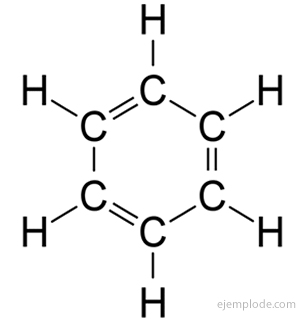
Bensenring
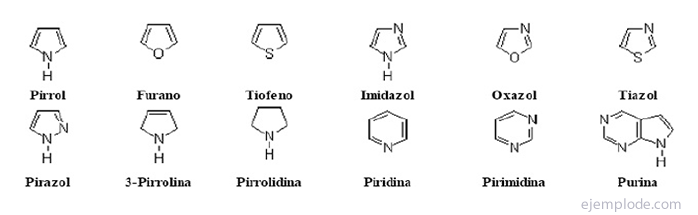
De heterocykliska föreningar De är föreningar med sluten kedja i vars ring det finns ett annat ämne än kol.
Enligt deras konstitution är de:
Kolväten, som i sin tur, på grund av den typ av länkar den har, klassificeras som Alkanes, Alkenes Y Alkynes. Dessutom ingår cykloalkaner, bensen och deras derivat endast av kol och väte i denna kategori.
Heterocykliska föreningar
Halogenerade derivat:R-X
Nitroföreningar:R-NO2
Sulfonsyror:R-SO3H
Nitriler (ELLER alkylcyanider) och isonitriler:R-CN och R-NC. De skiljer sig åt i hur kväveatomen är bunden i molekylen.
Alkoholer:R-OH
Fenoler: Föreningar baserade på en ryggrad bestående av en bensenring med en tillsatt hydroxylgrupp.

Eter:R-O-R
Mercaptans: R-SH
Tioetrar:R-S-R
Tiosyror:R-COSH
Aldehyder:R-CHO
Ketoner:R-CO-R
Karboxylsyror:R-COOH
Du går ut:R-COOM (M för metall)
Estrar: R-COO-R
Anhydrider: R-CO-O-OC-R
Aminer:R-NH2, R-NH-R, 2R-N-R
Aldosa typ kolhydrater:-CHOH-CHOH-CHO
Ketos-typ kolhydrater:-CHOH-CO-CH2Åh
Organometalliska föreningar:R-M-R
Metallalkylhalider:R-MX (även känd som Grignard Reagents)



