Exempel på Charles's Law
Fysik / / July 04, 2021
Charles gaslag eller lagen om konstant tryck, är en annan av gaslagarna, förkunnad av Gay-Lussac, som kände till Jacques Charles, publicerade omkring 20 år tidigare.
Charles lag förutsäger beteendet hos en gasmassa när trycket förblir konstant och temperaturen och volymen varierar.
Charles lag anges enligt följande:
Vid konstant tryck är gasens volym direkt proportionell mot temperaturförändringen.
Konstant tryck: det hänvisar till det faktum att trycket som gasen utövar på behållarens väggar inte varierar under hela upplevelsen.
Volym: det är det upptagna utrymmet som gasen upptar, i allmänhet anses det som en behållare med väggar som inte deformeras och vars lock fungerar som en kolv.
Temperatur: Det är den ökning eller förlust av värme som gasen genomgår under experimentet. Om temperaturen ökar ökar volymen. Om temperaturen sjunker minskar också volymen.
Algebraiskt uttrycks Charles lag med följande formel:

Var:
V = gasvolym
T = gastemperatur
k = proportionalitetskonstant för den gasmassan.
Detta betyder att för en given gasmassa, vid konstant tryck, förhållandet mellan volymen och temperaturvariationer, kommer alltid att ha samma proportionalitetsförhållande, representerat av konstanten k:

Så när konstanten har bestämts kan vi beräkna något av de andra värdena från andra kända data:
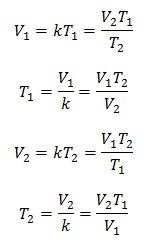
3 Exempel på Charles's Law tillämpade på problem:
Exempel 1: Beräkna den nya volymen, om det i en behållare finns en gasmassa som upptar en volym på 1,3 liter, vid en temperatur på 280 K. Beräkna volymen när du når en temperatur på 303 K.
V1 = 1,3 l.
T1 = 280 K.
V2 = ?
T2 = 303 K
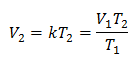
Ersätter värden:
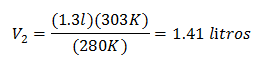
Den nya volymen vid 303 K är 1,41 liter.
Exempel 2. Om vi har en gas som upptar 2,4 liter vid 10 grader Celsius, beräkna den slutliga temperaturen, om den i slutet upptar 2,15 liter.
V1 = 2,4 l
T1 = 10 ° C = 283 K
V2 = 2,15 l
T2 = ?
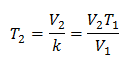
Ersätter värden:
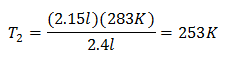
Den nya temperaturen är 253 K, vilket är lika med -20 ° C.
Exempel 3. Vi har en gas vars initialtemperatur är 328 K, dess slutliga volym är 3,75 l och dess förhållande konstant är 0,00885.
V1 = ?
T1 = 328 K
V2 = 3,75 l
T2 = ?
k = 0,00885
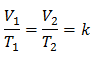
Ersätter värden:
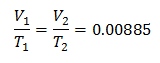
Att känna till den ursprungliga volymen:
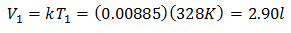
Startvolymen är 2,90 l.
Att veta den slutliga temperaturen:
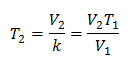
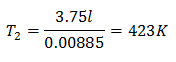
Den slutliga temperaturen blir 423 K, vilket är lika med 150 ° C.