ตัวอย่างกฎของชาร์ลส์
ฟิสิกส์ / / November 13, 2021
กฎแก๊สของชาร์ลส์ หรือ กฎความดันคงที่ เป็นกฎของแก๊สอีกชนิดหนึ่ง ประกาศโดย Gay-Lussac ผู้เผยแพร่ผลงานของ Jacques Charles ซึ่งตีพิมพ์เมื่อประมาณปี 20 ปีก่อน
กฎของชาร์ลส์ทำนายพฤติกรรมของมวลก๊าซเมื่อความดันคงที่และอุณหภูมิและปริมาตรแปรผัน
กฎของชาร์ลส์ระบุไว้ดังนี้:
ที่ความดันคงที่ ปริมาตรของก๊าซจะเป็นสัดส่วนโดยตรงกับการเปลี่ยนแปลงของอุณหภูมิ
แรงดันคงที่: หมายถึง ความจริงที่ว่าความดันที่ก๊าซกระทำต่อผนังของภาชนะนั้นจะไม่แปรผันไปตลอดประสบการณ์
ปริมาณ: เป็นพื้นที่ว่างที่แก๊สเข้าครอบครอง โดยทั่วไปแล้ว ถือว่าเป็นภาชนะที่มีผนังไม่เสียรูป และมีฝาปิดที่ทำงานเหมือนลูกสูบ
อุณหภูมิ: เป็นการเพิ่มขึ้นหรือสูญเสียความร้อนที่ก๊าซได้รับระหว่างการทดลอง หากอุณหภูมิเพิ่มขึ้น ปริมาตรจะเพิ่มขึ้น หากอุณหภูมิลดลง ปริมาตรจะลดลงด้วย
พีชคณิต กฎของชาร์ลส์แสดงด้วยสูตรต่อไปนี้:

ที่ไหน:
V = ปริมาตรแก๊ส
T = อุณหภูมิของแก๊ส
k = ค่าคงที่สัดส่วนของมวลก๊าซนั้น
ซึ่งหมายความว่าสำหรับมวลของก๊าซที่กำหนด ที่ความดันคงที่ ความสัมพันธ์ระหว่างปริมาตรกับ ความแปรผันของอุณหภูมิ จะมีความสัมพันธ์แบบสัดส่วนเท่ากันเสมอ แทนด้วยค่าคงที่ เค:

ดังนั้นเมื่อกำหนดค่าคงที่แล้ว เราสามารถคำนวณค่าอื่นๆ จากข้อมูลที่ทราบอื่นๆ ได้:
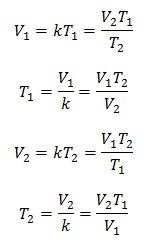
3 ตัวอย่างกฎของชาร์ลส์ที่ใช้กับปัญหา:
ตัวอย่างที่ 1: คำนวณปริมาตรใหม่หากในภาชนะมีมวลก๊าซที่มีปริมาตร 1.3 ลิตรที่อุณหภูมิ 280 K คำนวณปริมาตรเมื่อถึงอุณหภูมิ 303 K
วี1 = 1.3 ลิตร
NS1 = 280 K
วี2 = ?
NS2 = 303 K
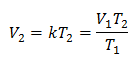
การแทนที่ค่า:
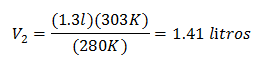
ปริมาณใหม่ที่ 303 K คือ 1.41 ลิตร
ตัวอย่าง 2. ถ้าเรามีก๊าซที่มีความจุ 2.4 ลิตร ที่ 10 องศาเซลเซียส ให้คำนวณอุณหภูมิสุดท้ายหากสิ้นสุดที่ 2.15 ลิตร
วี1 = 2.4 ลิตร
NS1 = 10 ° C = 283 K
วี2 = 2.15 ลิตร
NS2 = ?
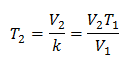
การแทนที่ค่า:
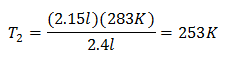
อุณหภูมิใหม่คือ 253 K ซึ่งเท่ากับ -20 ° C
ตัวอย่างที่ 3. เรามีก๊าซที่มีอุณหภูมิเริ่มต้น 328 K ปริมาตรสุดท้ายคือ 3.75 ลิตร และอัตราส่วนคงที่คือ 0.00885
วี1 = ?
NS1 = 328 K
วี2 = 3.75 ลิตร
NS2 = ?
k = 0.00885
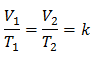
การแทนที่ค่า:
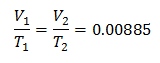
หากต้องการทราบปริมาณเริ่มต้น:
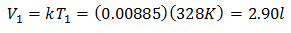
ปริมาตรเริ่มต้นคือ 2.90 ลิตร
หากต้องการทราบอุณหภูมิสุดท้าย:
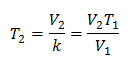
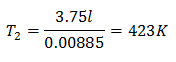
อุณหภูมิสุดท้ายจะอยู่ที่ 423 K ซึ่งเท่ากับ 150 ° C

