30 ตัวอย่างแอลกอฮอล์
ตัวอย่าง / / November 06, 2023
ที่ แอลกอฮอล์ เป็น สารประกอบเคมีอินทรีย์ ซึ่งมีหมู่ฟังก์ชันไฮดรอกซิล (- OH) ในโครงสร้างที่ติดอยู่กับคาร์บอน (- C) หมู่ (- C – OH) เรียกว่า “คาร์บินอล” ตัวอย่างของแอลกอฮอล์ได้แก่: เมทานอล เอทานอล และ 1-โพรพานอล
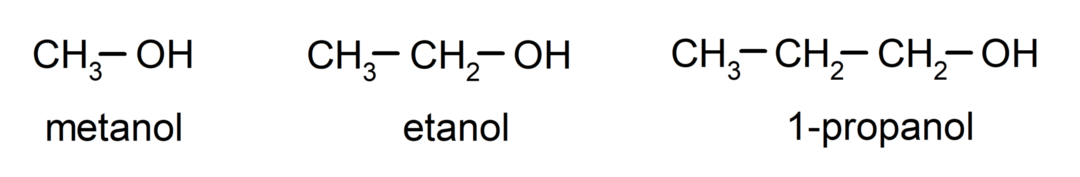
แอลกอฮอล์เป็นสารประกอบทางเคมีที่มีประโยชน์หลายอย่างในชีวิตประจำวัน เนื่องจากมีคุณสมบัติต้านเชื้อแบคทีเรียและน้ำยาฆ่าเชื้อ ในทางกลับกัน อาจเป็นอันตรายต่อสุขภาพของมนุษย์เมื่อรับประทานเข้าไปโดยไม่สามารถควบคุมได้
ในทำนองเดียวกัน มนุษย์ไม่สามารถกลืนแอลกอฮอล์ทุกชนิดได้
- ดูเพิ่มเติม: เอมีนและคีโตน
ประเภทของแอลกอฮอล์
ขึ้นอยู่กับจำนวนอะตอมของคาร์บอนที่อะตอมของคาร์บอนที่มีหมู่ไฮดรอกซิลติดอยู่ แอลกอฮอล์อาจเป็น:
- แอลกอฮอล์เบื้องต้น อะตอมของคาร์บอนที่มีหมู่ไฮดรอกซิลติดอยู่ก็เกาะติดกับอะตอมของคาร์บอนเดี่ยวเช่นกัน ตัวอย่างเช่น:
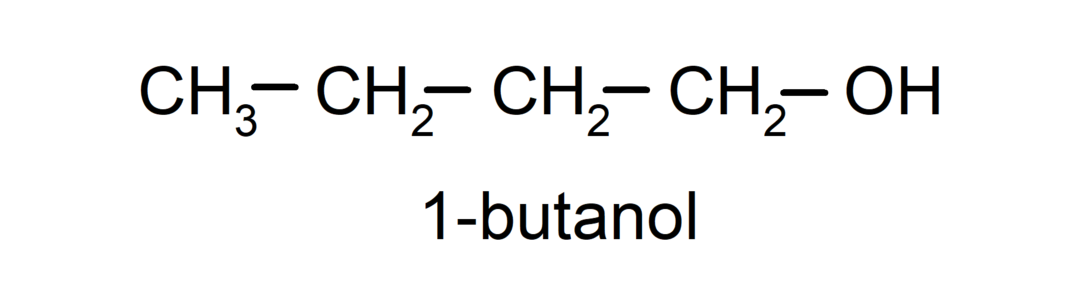
- แอลกอฮอล์ทุติยภูมิ อะตอมของคาร์บอนที่มีหมู่ไฮดรอกซิลติดอยู่นั้นจะถูกพันธะกับอะตอมของคาร์บอนอีกสองอะตอมด้วย ตัวอย่างเช่น:
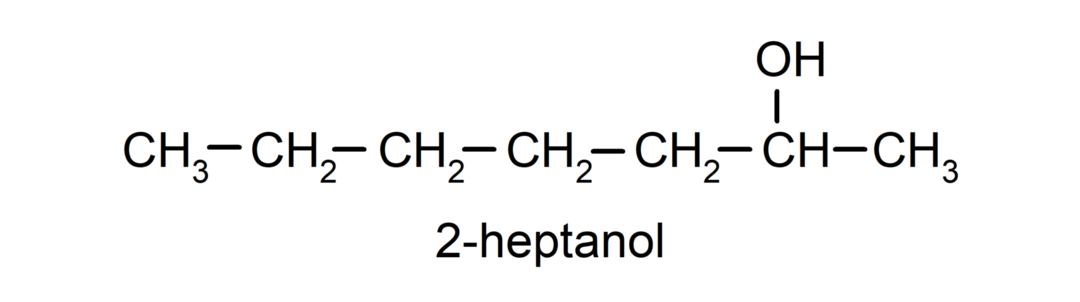
- แอลกอฮอล์ระดับอุดมศึกษา อะตอมของคาร์บอนที่มีหมู่ไฮดรอกซิลติดอยู่ก็เกาะติดกับอะตอมของคาร์บอนสามอะตอมเช่นกัน ตัวอย่างเช่น:
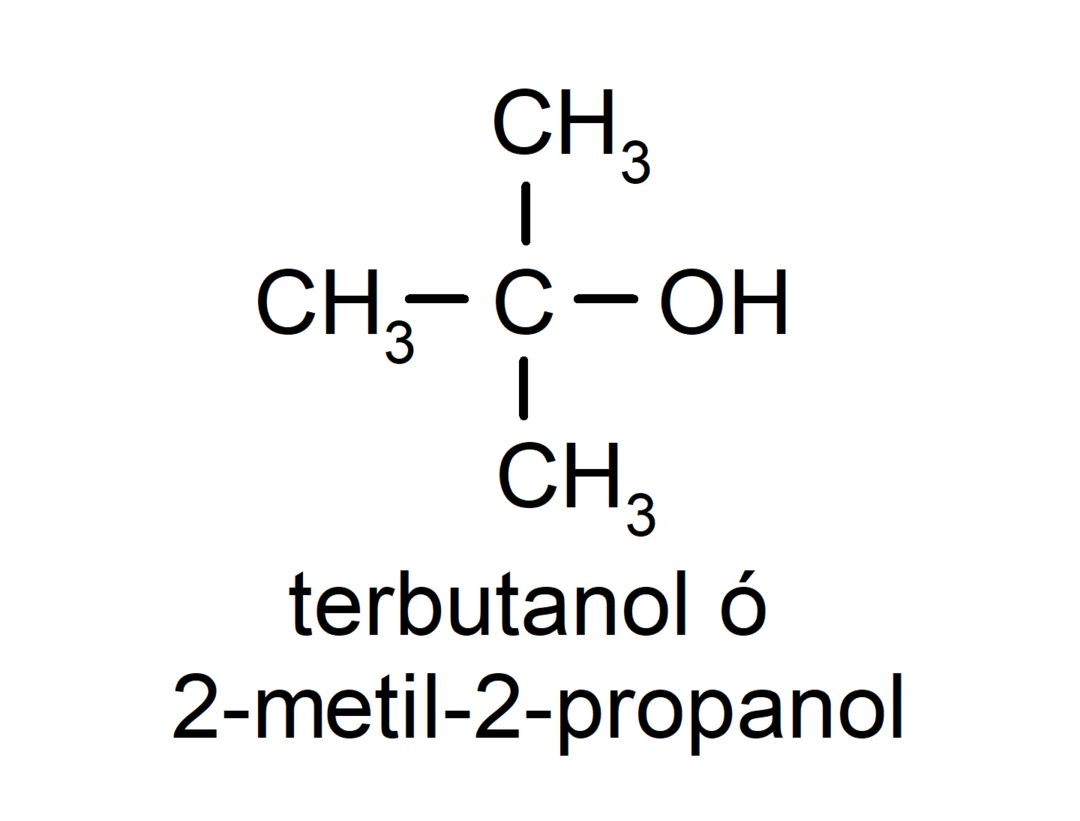
แอลกอฮอล์อาจเป็น: ขึ้นอยู่กับจำนวนกลุ่มไฮดรอกซิลที่มี:
- ไดออล. มีกลุ่มไฮดรอกซิลสองกลุ่มในโครงสร้าง ตัวอย่างเช่น:
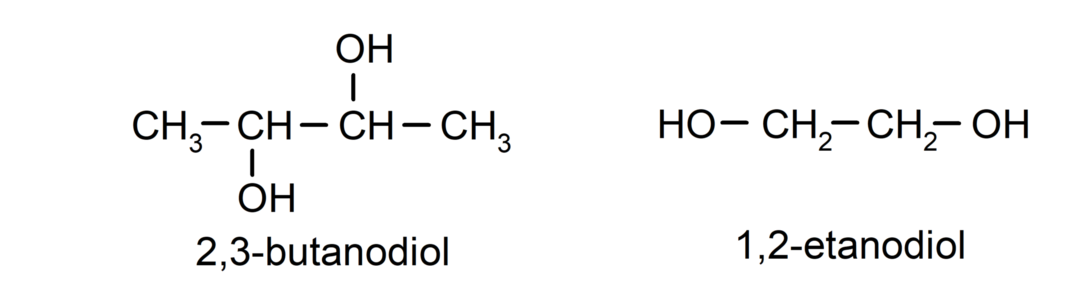
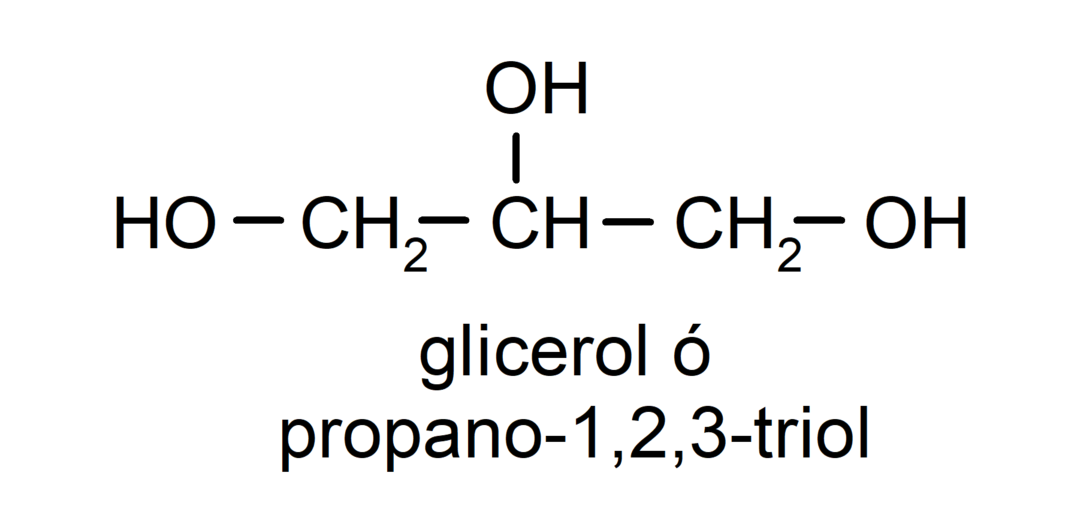
- ไตรออล มีกลุ่มไฮดรอกซิลสามกลุ่มในโครงสร้าง ตัวอย่างเช่น:
- โพลีแอลกอฮอล์ มีกลุ่มไฮดรอกซิลหลายกลุ่มในโครงสร้าง ตัวอย่างเช่น:
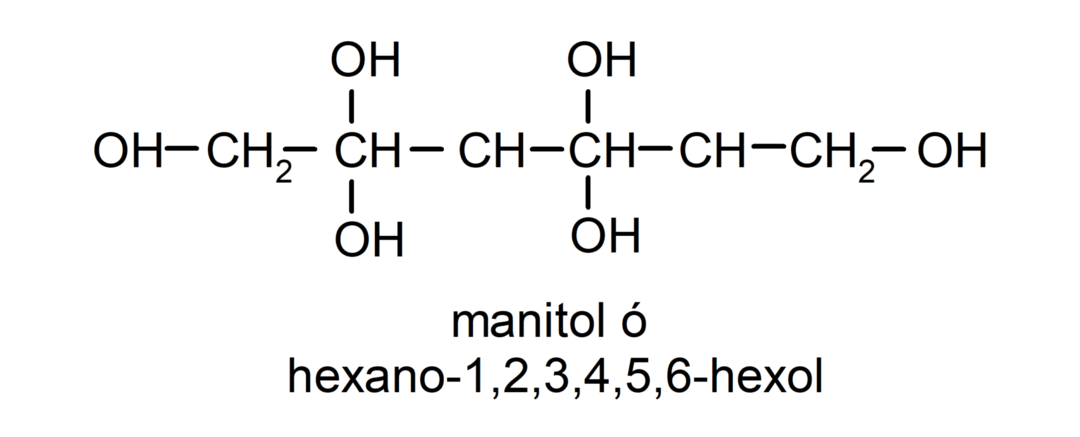
คุณสมบัติทางกายภาพของแอลกอฮอล์
คุณสมบัติทางกายภาพบางประการของแอลกอฮอล์คือ:
- จุดเดือด. จุดเดือดในแอลกอฮอล์ค่อนข้างสูงเนื่องจากมีหมู่ไฮดรอกซิลซึ่งทำให้เกิดพันธะไฮโดรเจน นอกจากนี้ ยิ่งหมู่ฟังก์ชันไฮดรอกซิลมีอยู่ในโซ่คาร์บอนมากเท่าใด ค่ายิ่งสูงเท่านั้น จุดเดือด ของแอลกอฮอล์
- ขั้ว. แอลกอฮอล์เป็นสารประกอบที่มีขั้วค่อนข้างมาก
- ความสามารถในการละลาย. แอลกอฮอล์น้ำหนักโมเลกุลต่ำสามารถละลายได้ในน้ำ ในทางกลับกัน ยิ่งโซ่คาร์บอนของแอลกอฮอล์มีขนาดใหญ่ ความสามารถในการละลายน้ำก็จะยิ่งลดลง นอกจากนี้ ยิ่งแอลกอฮอล์ของกลุ่มไฮดรอกซิลมีมากเท่าใด ความสามารถในการละลายน้ำก็จะยิ่งมากขึ้นเท่านั้น
- สถานะของการรวมตัว. แอลกอฮอล์ส่วนใหญ่เป็นของเหลวที่อุณหภูมิห้อง (25°C) และมีกลิ่นเฉพาะตัว
คุณสมบัติทางเคมีของแอลกอฮอล์
คุณสมบัติทางเคมีบางประการของแอลกอฮอล์คือ:
- แอลกอฮอล์มีพฤติกรรมเหมือนกรดและเบส. พฤติกรรมของพวกมันในฐานะกรดสามารถเห็นได้ในปฏิกิริยากับโลหะแอคทีฟเพื่อปล่อยก๊าซไฮโดรเจนและก่อตัวเป็นอัลคอกไซด์

พฤติกรรมของพวกมันในฐานะเบสสามารถเห็นได้ในปฏิกิริยาเช่นปฏิกิริยาของเมธานอลกับไฮโดรเจนโบรไมด์เพื่อสร้างเมทิลออกโซเนียมโบรไมด์
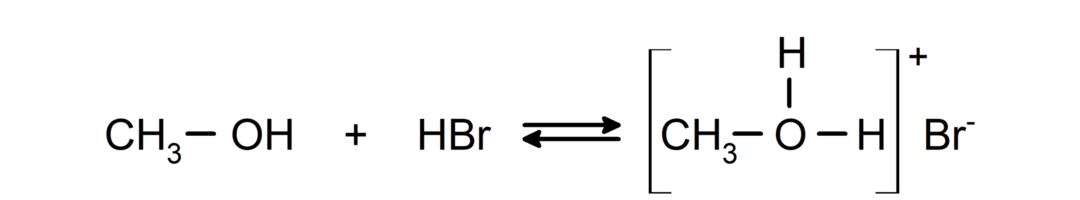
- แอลกอฮอล์เกิดปฏิกิริยาฮาโลเจน. พวกมันทำปฏิกิริยากับไฮโดรเจนเฮไลด์เพื่อสร้างอัลคิลเฮไลด์
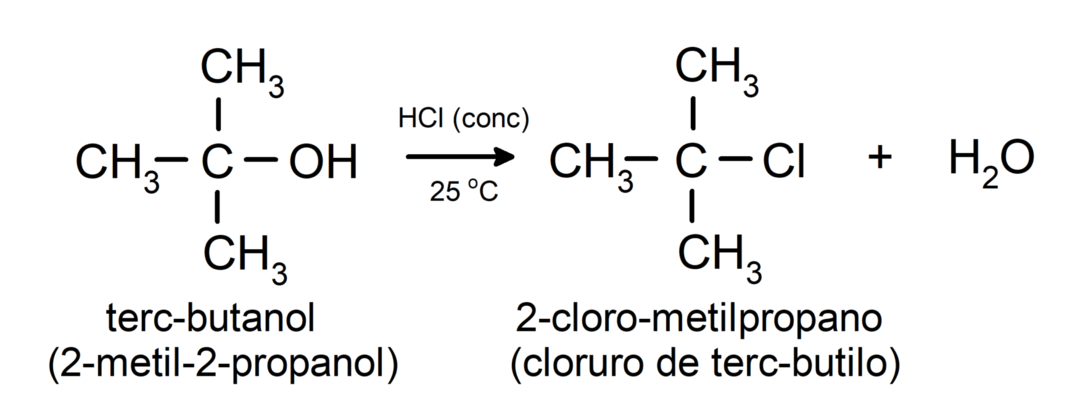
-
แอลกอฮอล์เกิดปฏิกิริยาออกซิเดชั่น เมื่อทำปฏิกิริยากับสารประกอบออกซิไดซ์บางชนิด ผลิตภัณฑ์ของปฏิกิริยาออกซิเดชันขึ้นอยู่กับประเภทของปฏิกิริยาแอลกอฮอล์ กล่าวคือ ไม่ว่าจะเป็นปฏิกิริยาปฐมภูมิ ทุติยภูมิ หรือตติยภูมิ
ออกซิเดชันของแอลกอฮอล์ปฐมภูมิเพื่อสร้างอัลดีไฮด์หรือกรดคาร์บอกซิลิก
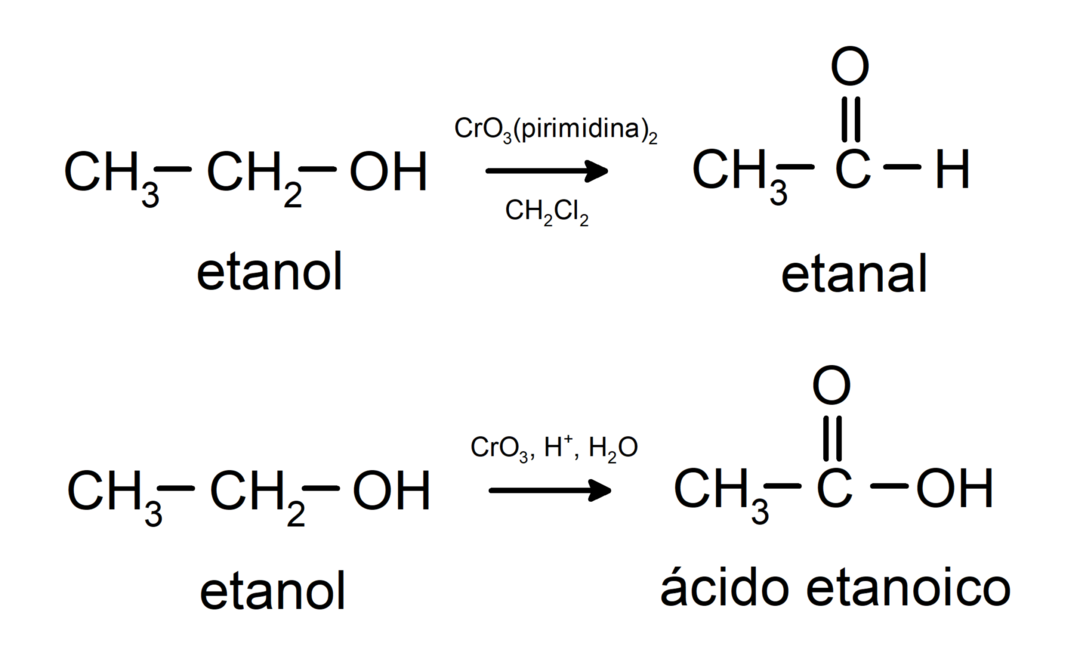
ออกซิเดชันของแอลกอฮอล์ทุติยภูมิเพื่อสร้างคีโตน
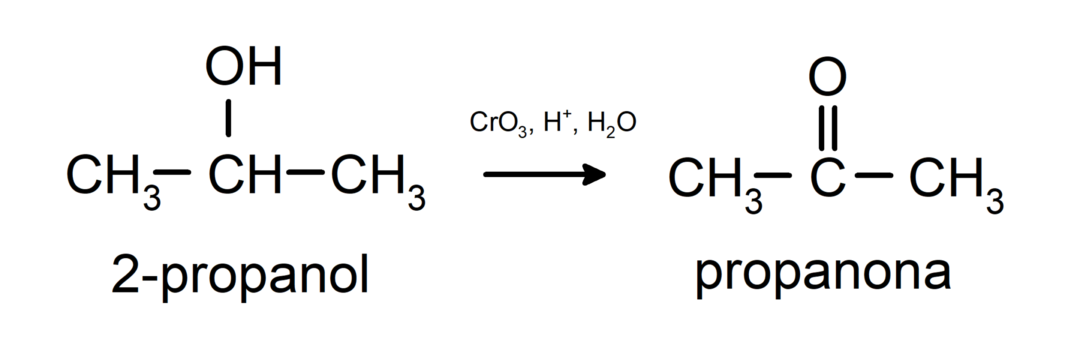
แอลกอฮอล์ระดับตติยภูมิจะไม่ออกซิไดซ์กับสารออกซิแดนท์ทั่วไป ด้วยสารออกซิไดซ์ที่แรงมาก พวกมันสามารถเปลี่ยนเป็นอัลคีน ซึ่งจากนั้นก็สามารถออกซิไดซ์ได้
แอลกอฮอล์ที่มีหมู่ไฮดรอกซิลสองหมู่อยู่บนคาร์บอนที่อยู่ติดกันจะถูกออกซิไดซ์ด้วยตะกั่วเตตราอะซิเตตเพื่อสร้างคีโตนสองตัว
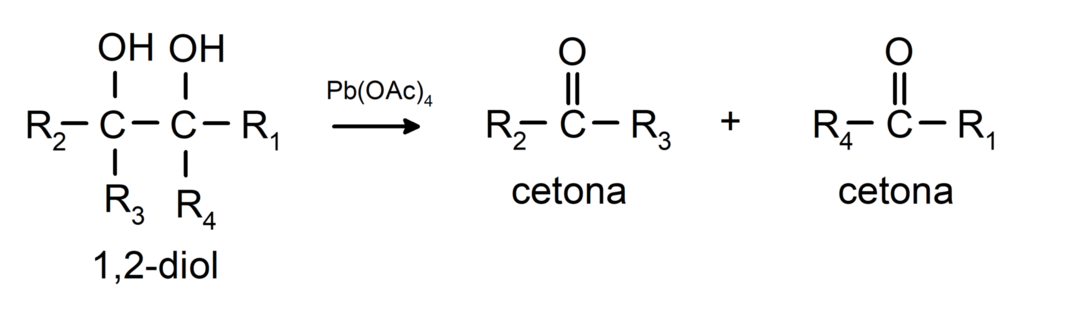
- แอลกอฮอล์เกิดปฏิกิริยาดีไฮโดรจีเนชัน. ปฏิกิริยาเหล่านี้เกิดขึ้นเฉพาะกับแอลกอฮอล์ปฐมภูมิและทุติยภูมิเท่านั้น ซึ่งเมื่ออยู่ภายใต้อุณหภูมิสูงโดยมีตัวเร่งปฏิกิริยา จะปล่อยไฮโดรเจนออกมา
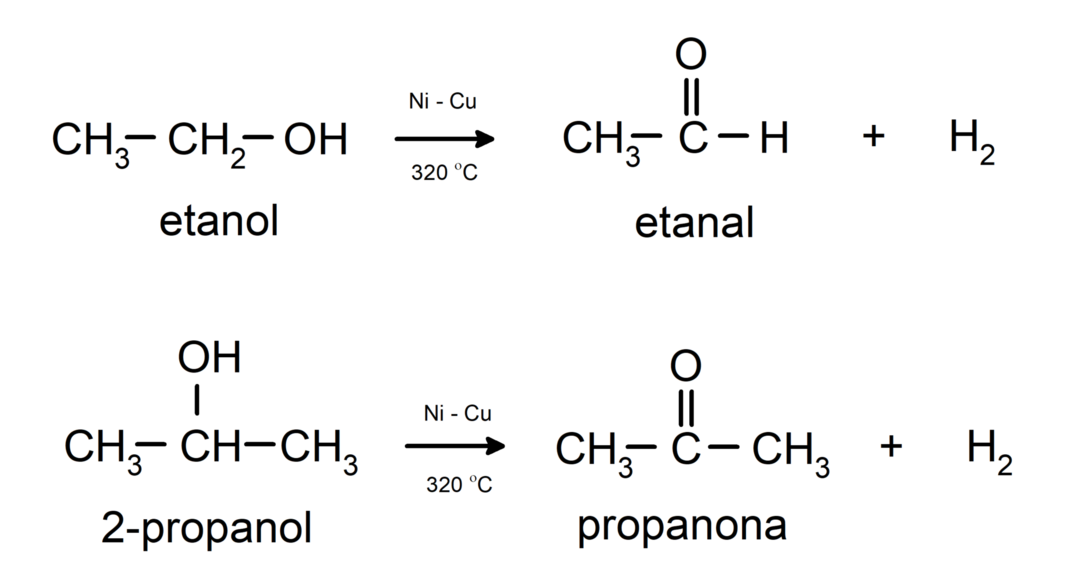
- แอลกอฮอล์เกิดปฏิกิริยาขาดน้ำ. แอลกอฮอล์จะสูญเสียน้ำเพื่อสร้างอัลคีนที่สอดคล้องกัน ปฏิกิริยานี้เกิดขึ้นเมื่อมีกรดและอุณหภูมิปานกลาง
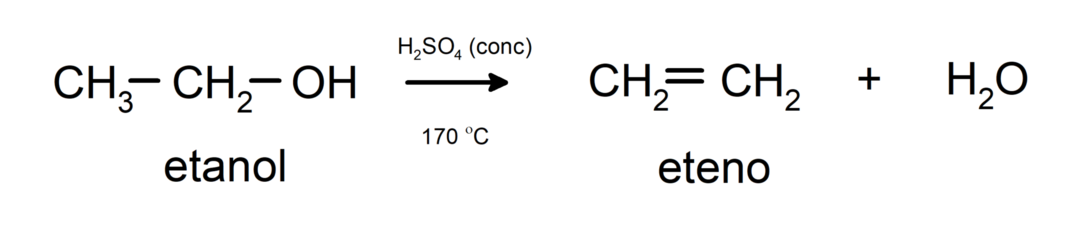
การตั้งชื่อแอลกอฮอล์
ตามระบบการตั้งชื่อที่กำหนดโดย IUPAC (International Union of Pure and Applied Chemistry) แอลกอฮอล์จะถูกตั้งชื่อตามกฎต่อไปนี้:
- ตำแหน่งของกลุ่มไฮดรอกซิลถูกเลือกโดยคำนึงถึงจำนวนที่ต่ำที่สุดในห่วงโซ่คาร์บอน ถ้าโครงสร้างของแอลกอฮอล์เป็นแบบไซคลิก ตำแหน่งที่ 1 บนคาร์บอนที่มีหมู่ไฮดรอกซิลติดอยู่จะได้รับการพิจารณา และใช้คำนำหน้าไซโคล- เพื่อตั้งชื่อ
- ชื่อของแอลกอฮอล์เขียนโดยใช้คำนำหน้าซึ่งระบุจำนวนอะตอมในห่วงโซ่คาร์บอนและนอกจากนี้ยังใส่คำต่อท้าย -ol อีกด้วย
- หากโครงสร้างของแอลกอฮอล์มีกิ่งก้าน โซ่ที่ยาวที่สุดซึ่งมีหมู่ไฮดรอกซิลจะถูกเลือกเป็นโซ่คาร์บอนหลัก
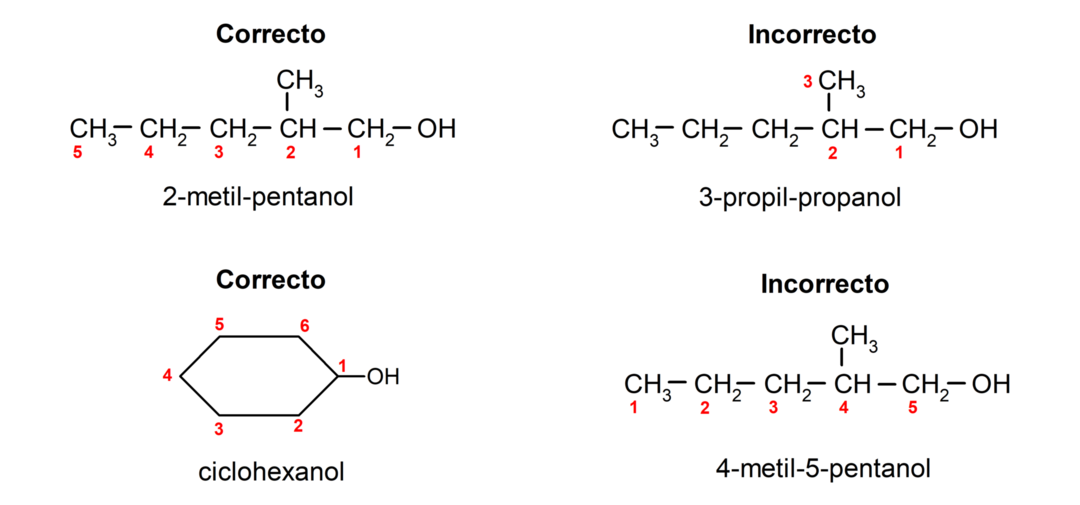
ตามระบบการตั้งชื่อแบบดั้งเดิม แอลกอฮอล์จะถูกตั้งชื่อโดยการเขียนคำว่า "แอลกอฮอล์" แล้วจึงเขียนชื่อแอลกอฮอล์ อัลเคนที่สอดคล้องกับโซ่คาร์บอน แต่แทนที่จะใช้จุดสิ้นสุด -ane ของอัลเคน กลับกลายเป็นจุดสิ้นสุด -อิลลิค
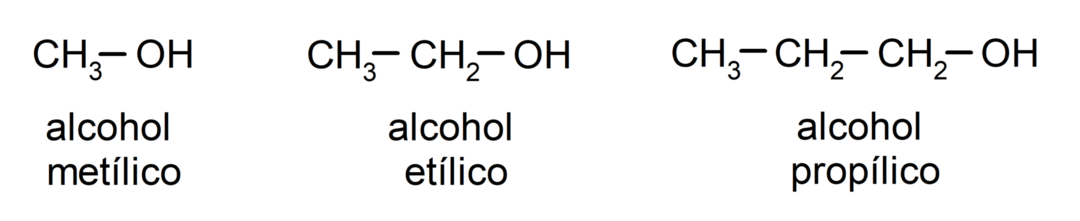
ตัวอย่างแอลกอฮอล์
- เมทานอล
- เอทานอล
- 1-โพรพานอล
- 2-โพรพานอล
- 1-บิวทานอล
- 3-เอทิลเฮกซัน-2-ออล
- กลีเซอรอล
- ฟีนอล
- 2-เมทิล-2-บิวทานอล
- 1,2-เอเทนไดออล
- 1,5-เฮปตาเดียน-3-ออล
- 3-เมทิล-2-บิวทานอล
- เบนซิลเมทานอล
- 3-เพนทานอล
- 2-เมทิลฟีนอล
- 1,2-ไดไฮดรอกซีฟีนอล
- ไซโคลเฮกโนล
- 1-ฟีนิลเอทานอล


การใช้แอลกอฮอล์
การใช้แอลกอฮอล์ที่พบบ่อยที่สุดคือ:
- พวกมันถูกใช้เป็นยาฆ่าเชื้อและน้ำยาฆ่าเชื้อเนื่องจากพวกมันหยุดการเจริญเติบโตของบางชนิด จุลินทรีย์ หรือทำลายพวกเขา เอทานอลและไอโซโพรพิลแอลกอฮอล์ถูกใช้มากที่สุดเพื่อจุดประสงค์นี้
- ใช้ในการสังเคราะห์สารต่างๆ สารประกอบเคมี. ตัวอย่างเช่น เมทานอลถูกใช้เพื่อให้ได้เมทานอล (ฟอร์มาลดีไฮด์)
- พวกมันถูกใช้ในการผลิตสารป้องกันการแข็งตัว เมทานอลเป็นหนึ่งในสารที่ใช้มากที่สุดเพื่อจุดประสงค์นี้
- ใช้เป็นตัวทำละลายในอุตสาหกรรมยา เอทานอลเป็นหนึ่งในสิ่งที่ใช้มากที่สุดในแง่นี้
- ใช้เป็นตัวทำละลายสำหรับแลคเกอร์ สีย้อม และหมึกพิมพ์ เมทานอลถูกนำมาใช้กันอย่างแพร่หลายเพื่อจุดประสงค์นี้
- ใช้เป็นเชื้อเพลิงและมีแนวโน้มสำคัญที่จะทดแทนการใช้บางส่วน พลังงานจากถ่านหิน โดยการใช้เชื้อเพลิงเอทานอล
- พวกมันใช้ทำเรซิน ฟีนอลถูกใช้ในแง่นี้
อันตรายจากการบริโภคเครื่องดื่มแอลกอฮอล์
แม้ว่าการบริโภคเครื่องดื่มแอลกอฮอล์จะเป็นที่ยอมรับของสังคมในปัจจุบัน แต่การใช้สารนี้ในทางที่ผิดทำให้เกิดการพึ่งพาอาศัยกันและติดยาเสพติด
เอทานอลเป็นแอลกอฮอล์ที่มีอยู่ในเครื่องดื่มแอลกอฮอล์ ซึ่งเมื่อบริโภคมากเกินไปจะส่งผล ความสามารถทางปัญญาและอาจก่อให้เกิดโรคหลอดเลือดหัวใจ โรคตับแข็ง และ มะเร็ง.
นอกจากนี้ เมื่อถึงระดับความมึนเมาของแอลกอฮอล์ นั่นก็คือ ภาวะเมาสุรา ถ้าปริมาณของ แอลกอฮอล์สูงเกินไป อาจเกิดอาการโคม่าจากแอลกอฮอล์ ซึ่งอาจทำให้ระบบทางเดินหายใจเป็นอัมพาตและอาจถึงแก่ชีวิตได้ ความตาย.
อ้างอิง
- ต. ถึง. ไกส์แมน. (1974) “หลักการเคมีอินทรีย์” ฉบับพิมพ์ครั้งที่สอง. บทบรรณาธิการ Reverté, S.A. ไอเอสบีเอ็น: 8429171800
- อาฮูมาดา-คอร์เตซ เจ. จี., กาเมซ-เมดินา, เอ็ม. อี., & วาลเดซ-มอนเตโร, ซี. (2017). การบริโภคเครื่องดื่มแอลกอฮอล์เป็นปัญหาด้านสาธารณสุข รา ซิมไห่, 13(2), 13-24.
- มอร์ริสัน อาร์. ที. และ บอยด์ อาร์. เอ็น. (1998). เคมีอินทรีย์. การศึกษาของเพียร์สัน
- ไวน์นิงเกอร์, เอส. เจ. และสเตอร์มิทซ์, เอฟ. ร. (1988). เคมีอินทรีย์. ฉันย้อนกลับ
ติดตามด้วย:
- เอทิลแอลกอฮอล์
- เชื้อเพลิง
- เคมีอินทรีย์



