ตัวอย่างพันธะโควาเลนต์
เคมี / / July 04, 2021
พันธะโควาเลนต์ เป็นที่หนึ่งที่ สองอะตอมรวมกันโดยใช้อิเล็กตรอนร่วมกันเพื่อทำให้กฎของออคเต็ตของคุณสมบูรณ์
ประวัติของพันธะโควาเลนต์
ในช่วงต้นศตวรรษที่ 20 นักเคมีเริ่มเข้าใจว่าโมเลกุลเกิดขึ้นได้อย่างไรและทำไม ความก้าวหน้าครั้งสำคัญครั้งแรกมาพร้อมกับข้อเสนอของ กิลเบิร์ต ลูอิส เกี่ยวกับอะไร การก่อตัวของพันธะเคมี หมายความว่า อะตอมแบ่งอิเล็กตรอน. Lewis อธิบายการก่อตัวของพันธะเคมีในไฮโดรเจนว่า:
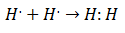
การจับคู่อิเล็กตรอนประเภทนี้เป็นตัวอย่างของพันธะโควาเลนต์ ซึ่งเป็นพันธะที่ อิเล็กตรอนสองตัวถูกแบ่งโดยสองอะตอม. สารประกอบโควาเลนต์ พวกเขานั่นแหละ มีพันธะโควาเลนต์เท่านั้น.
อิเล็กตรอนในพันธะโควาเลนต์
เพื่อความเรียบง่าย คู่อิเล็กตรอนที่ใช้ร่วมกัน มักจะแสดงเป็น แถวเดียว การเชื่อมต่อสัญลักษณ์ขององค์ประกอบ ดังนั้นพันธะโควาเลนต์ของโมเลกุลไฮโดรเจนจึงเขียนเป็น H-H
ในพันธะโควาเลนต์ อิเล็กตรอนแต่ละตัวของคู่ที่ใช้ร่วมกัน ถูกดึงดูดไปยังนิวเคลียสของอะตอมทั้งสอง. แรงดึงดูดนี้ยึดอะตอมทั้งสองในโมเลกุล H ไว้ด้วยกัน2 และมีหน้าที่ในการสร้างพันธะโควาเลนต์ในโมเลกุลอื่น
ในพันธะโควาเลนต์ระหว่างอะตอมของอิเล็กตรอนหลายตัว มีเพียงเวเลนซ์อิเล็กตรอนเท่านั้นที่เข้าร่วม
ซึ่งอยู่นอกสุดในวงโคจรที่ตื้นที่สุด ระหว่างหนึ่งถึงสามคนจะเข้าร่วมในสหภาพอิเล็กตรอนอื่น ๆ ที่ไม่มีส่วนร่วมในพันธะนี้เรียกว่า อิเล็กตรอนไม่พันธะหรือถ้าเราจัดเป็นคู่ คู่ฟรี. นั่นคือคู่ของวาเลนเซียอิเล็กตรอนที่ ไม่เข้าร่วมในการสร้างพันธะโควาเลนต์.
ตัวแทนพันธบัตรโควาเลนต์
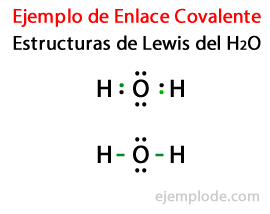
โครงสร้างที่แสดงสารประกอบโควาเลนต์ เช่น H2 และ F2 เรียกว่า โครงสร้างลูอิส. โครงสร้าง Lewis คือ a การแสดงพันธะโควาเลนต์โดยที่คู่ของอิเล็กตรอนที่ใช้ร่วมกัน ระบุด้วยเส้นหรือเป็นคู่ของจุดระหว่างสองอะตอมและคู่อิสระที่ไม่แบ่งใช้จะถูกระบุเป็นคู่ของคะแนนบนแต่ละอะตอม ในโครงสร้างลูอิส จะแสดงเฉพาะเวเลนซ์อิเล็กตรอนเท่านั้น ไม่ใช่อิเล็กตรอนภายใน
พิจารณาโครงสร้างลูอิสสำหรับโมเลกุลของน้ำ H2หรือวาเลนซ์อิเล็กตรอนทั้งหมดของอะตอมไฮโดรเจนและออกซิเจนจะถูกทำเครื่องหมายด้วยจุดก่อน
ในกรณีที่สอง ลิงก์จะถูกทำเครื่องหมายด้วยเส้น และคู่ฟรีที่จะมีอยู่ใน Oxygen เท่านั้น โดยมีแต้ม
กฎของออคเต็ต
การก่อตัวของโมเลกุลเหล่านี้ เช่นเดียวกับของ Water H2หรือแสดงการโทร กฎออคเต็ตเสนอโดยลูอิส: อะตอมอื่นที่ไม่ใช่ไฮโดรเจนมีแนวโน้มที่จะสร้างพันธะจนล้อมรอบตัวเองด้วย เวเลนซ์อิเล็กตรอนแปดตัวนั่นคือพันธะโควาเลนต์เกิดขึ้นเมื่อมีอิเล็กตรอนไม่เพียงพอสำหรับอะตอมแต่ละตัวเพื่อทำให้อ็อกเต็ตสมบูรณ์
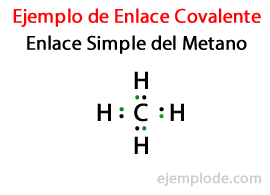
โดยการแบ่งปันอิเล็กตรอนในพันธะโควาเลนต์ แต่ละอะตอมมีออคเต็ตสมบูรณ์. สำหรับไฮโดรเจน ข้อกำหนดคือคุณต้องได้รับการกำหนดค่าอิเล็กตรอนของฮีเลียม ซึ่งจะต้องมีอิเล็กตรอนทั้งหมด 2 ตัว
กฎออกเตตทำงานเป็นหลัก สำหรับองค์ประกอบของคาบที่สองหรือแถวของตารางธาตุ. องค์ประกอบเหล่านี้มีระดับย่อยที่สามารถมีได้ทั้งหมดแปดอิเล็กตรอน
เมื่ออะตอมของธาตุเหล่านี้ก่อตัวเป็นสารประกอบโควาเลนต์ จะได้รับการกำหนดค่าทางอิเล็กทรอนิกส์ของก๊าซนีออนโนเบิล โดยใช้อิเล็กตรอนร่วมกับอะตอมอื่นๆ ในสารประกอบเดียวกัน
ประเภทของพันธบัตรโควาเลนต์
อะตอมสามารถสร้างพันธะโควาเลนต์ได้หลายประเภท: เดี่ยว คู่ หรือ สามคน.
ใน ลิงค์ง่ายๆ, อะตอมสองอะตอมรวมกันด้วยวิธีการของ คู่ของอิเล็กตรอน. เกิดขึ้นในสารประกอบโควาเลนต์ส่วนใหญ่ และเป็นรูปแบบพื้นฐานที่สุดของพันธะนี้
ในหลาย ๆ สารประกอบ ลิงค์คู่นั่นคือเมื่อสองอะตอมแบ่งกัน อิเล็กตรอนสองคู่. ถ้าอะตอมสองอะตอมใช้อิเล็กตรอนร่วมกันสองคู่ พันธะโควาเลนต์จะเรียกว่าพันธะคู่ พันธะเหล่านี้พบได้ในโมเลกุลเช่นคาร์บอนไดออกไซด์ (CO2) และเอทิลีน (C2โฮ4).

อา ทริปเปิ้ลลิงค์ เกิดขึ้นเมื่อสองอะตอมแบ่งกัน อิเล็กตรอนสามคู่เช่นเดียวกับในโมเลกุลไนโตรเจน N2, โมเลกุลอะเซทิลีนซี2โฮ2.

พันธะหลายตัวสั้นกว่าพันธะโควาเลนต์เดี่ยว ความยาวลิงค์ Link ถูกกำหนดให้เป็น ระยะห่างระหว่างนิวเคลียสของอะตอมสองอะตอม โดยพันธะโควาเลนต์ในโมเลกุล
ความแตกต่างระหว่างสารประกอบโควาเลนต์และอิออน
สารประกอบไอออนิกและโควาเลนต์มีความแตกต่างกันอย่างชัดเจนในคุณสมบัติทางกายภาพโดยทั่วไป เนื่องจากพันธะของพวกมันมีลักษณะต่างกัน
ใน สารประกอบโควาเลนต์ มีอยู่ แรงดึงดูดสองประเภท; หนึ่งในนั้นคือ ที่ยึดอะตอมของโมเลกุลไว้ด้วยกัน. การวัดเชิงปริมาณของแหล่งท่องเที่ยวนี้คือ พลังงานผูกพัน. แรงดึงดูดอีกอันทำงานระหว่างโมเลกุลทั้งหมดและเรียกว่า แรงระหว่างโมเลกุล. เนื่องจากแรงระหว่างโมเลกุลมักจะอ่อนแอกว่าแรงที่ยึดอะตอมของโมเลกุลไว้ด้วยกัน โมเลกุลของพันธะโควาเลนต์จึงมีแรงน้อยกว่า
ผลที่ตามมาคือ สารประกอบโควาเลนต์มักเป็นก๊าซ ของเหลว หรือของแข็งที่ละลายต่ำ lowน. ในทางกลับกัน แรงไฟฟ้าสถิตที่ยึดไอออนไว้ด้วยกัน ในสารประกอบไอออนิก พวกมันมักจะแข็งแรงมากเพื่อให้สารประกอบไอออนิกเป็นของแข็งที่อุณหภูมิห้องและมีจุดหลอมเหลวสูง สารประกอบไอออนิกหลายชนิดสามารถละลายได้ในน้ำ และสารละลายที่เป็นน้ำของพวกมันจะนำไฟฟ้าเนื่องจากสารประกอบเหล่านี้เป็นอิเล็กโทรไลต์ที่แรง
ส่วนใหญ่ สารประกอบโควาเลนต์ไม่ละลายในน้ำและถ้าละลายหมด สารละลายที่เป็นน้ำ เหมือนอย่างเคย ไม่นำไฟฟ้า เพราะสารประกอบเหล่านี้ไม่ใช่อิเล็กโทรไลต์ สารประกอบไอออนิกหลอมเหลวนำไฟฟ้าเพราะมีไอออนบวกและแอนไอออนที่เคลื่อนที่ได้อย่างอิสระ สารประกอบโควาเลนต์เหลวหรือหลอมเหลวไม่นำไฟฟ้าเนื่องจากไม่มีไอออนอยู่
ตัวอย่างของสารประกอบพันธะโควาเลนต์
- อะเซทิลีน C2โฮ2
- มีเทน CH4
- อีเทน C2โฮ6
- โพรเพน C3โฮ8
- บิวเทน C4โฮ10
- เบนซิน C6โฮ6
- โทลูอีน C7โฮ8
- เมทิลแอลกอฮอล์CH3โอ้
- เอทิลแอลกอฮอล์C2โฮ5โอ้
- โพรพิลแอลกอฮอล์ C3โฮ7โอ้
- เมทิลอีเธอร์ CH3OCH3
- เมทิล เอทิล อีเธอร์ C2โฮ5OCH3
- เอทิลอีเธอร์ C2โฮ5OC2โฮ5
- กรดฟอร์มิกHCOOH
- กรดอะซิติกCH3COOH
- กรดโพรพิโอนิก C2โฮ5COOH
- กรดบิวทิริก C3โฮ7COOH
- คาร์บอนไดออกไซด์CO2
- คาร์บอนมอนอกไซด์CO
- ไนโตรเจนโมเลกุล N2
- โมเลกุลไฮโดรเจนH2