ตัวอย่างกฎของบอยล์
ฟิสิกส์ / / July 04, 2021
เมื่อศึกษาคุณสมบัติของก๊าซ โรเบิร์ต บอยล์, ด้านหนึ่งและ Edme mariotteoในอีกทางหนึ่ง พวกเขาสังเกตเห็นว่าก๊าซสามารถถูกบีบอัดได้ โดยที่ไม่รู้หรือไม่รู้การทดลองของพวกเขา และปริมาตรของพวกมันจะแปรผันตามสัดส่วนของแรงดันที่พวกมันถูกกระทำ
เพื่อให้เข้าใจงานวิจัยของเขา เราต้องจำไว้ว่ามีสามลักษณะที่ต้องพิจารณาในการศึกษาก๊าซนี้: อุณหภูมิ ปริมาตร และความดัน
อุณหภูมิ: เป็นอุณหภูมิที่พบก๊าซภายใต้เงื่อนไขของการทดลอง สามารถแสดงเป็นองศาเซนติเกรด (° C) หรือหน่วยองศาเคลวินหรือศูนย์สัมบูรณ์ (° K) ในกรณีของกฎของบอยล์ ถือว่าอุณหภูมิไม่แปรผัน กล่าวคือ คงที่
ปริมาตร: เป็นพื้นที่ที่ก๊าซใช้อยู่ภายในภาชนะปิด ประการแรก ปริมาตรของแก๊สคือปริมาตรของภาชนะ สำหรับการเป็นตัวแทน ให้ถือว่าภาชนะปิดสนิทและมีลูกสูบ เช่น กระบอกฉีดยา
ความดัน: เป็นความดันที่ก๊าซมีผ่านลูกสูบ ในภาชนะปิดซึ่งวางลูกสูบไว้เป็นฝาโดยไม่ต้องใช้แรงดันถือว่าอยู่ที่ความดันบรรยากาศ (1 at)
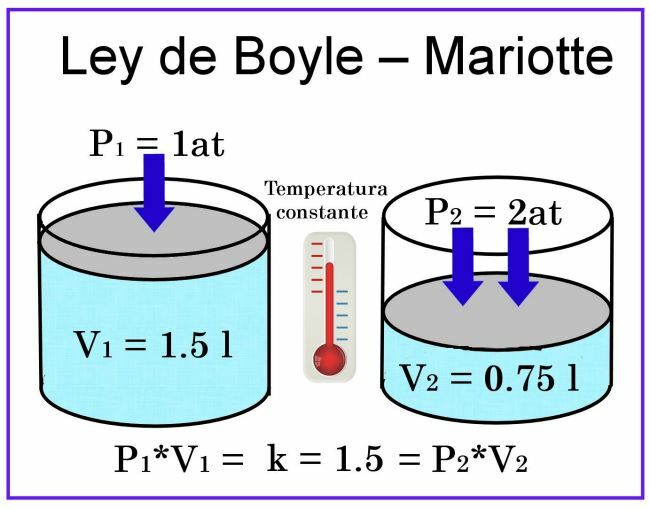
ในการสังเกตของ Boyle และ Mariotte อุณหภูมิจะถือว่าคงที่ ดังนั้นจะไม่ส่งผลต่อการวัด
เรื่องปริมาตรถ้าเราพิจารณา เช่น ภาชนะทรงกระบอกความจุ 1 ลิตร และฝาเป็นลูกสูบ เลื่อนเมื่อวางคลุมภาชนะที่เติมอากาศความดันจะเป็น 1 ในขณะที่ปริมาตรจะเป็น1 ลิตร. หากกดลูกสูบ 2 บรรยากาศ ปริมาตรของแก๊สจะลดลงครึ่งหนึ่ง นั่นคือ 0.5 ลิตรหรือ 500 มล. หากความดันเพิ่มขึ้นเป็น 4 บรรยากาศ ปริมาตรจะลดลงเหลือหนึ่งในสี่ นั่นคือ 0.25 ลิตรหรือ 250 มล.
จากการสังเกตเหล่านี้ การโทรได้รับการประกาศ กฎของบอยล์: ที่อุณหภูมิคงที่ ปริมาตรของแก๊สจะแปรผกผันกับแรงดันที่กระทำต่อมัน
ซึ่งหมายความว่าเมื่อความดันเพิ่มขึ้น ปริมาตรจะลดลง และเมื่อความดันลดลง ปริมาตรจะเพิ่มขึ้น
สิ่งนี้นำไปสู่การพิสูจน์ว่ามีความสัมพันธ์ระหว่างความดันของก๊าซกับปริมาตรของมัน ซึ่งแปรผันตาม องค์ประกอบหนึ่ง อีกส่วนแปรผันในสัดส่วนเดียวกัน ความสัมพันธ์คงอยู่คงที่ นั่นคือ พูด:
P * V = k
P = ความดัน
V = ปริมาณ
k = ค่าคงที่ของความสัมพันธ์ระหว่างความดันและปริมาตร
เพื่อให้เข้าใจ สมมติว่าเรามีภาชนะขนาด 2.5 ลิตร ซึ่งเต็มไปด้วยอากาศและความดันบนฝาลูกสูบเท่ากับ 1.5 ที่ ค่าคงที่ของความสัมพันธ์ของคุณคือ:
P * V = k = (2.5) (1.5) = 3.75
หากตอนนี้เราเพิ่มความดันเป็น 3 บรรยากาศ เราหาร k ด้วยความดัน P แล้วเราจะได้:
k / P = V
3.75 / 3 = 1.25 ลิตร
ดังที่เราเห็น เมื่อใช้แรงกดสองเท่า ปริมาตรจะเป็นครึ่งหนึ่งของต้นฉบับ และค่าคงที่ของความสัมพันธ์ระหว่างความดันกับปริมาตร นี้แสดงดังต่อไปนี้:
วี1พี1 = ว2พี2 = k
นั่นคือผลคูณของปริมาตร 1 คูณแรงดัน 1 เท่ากับผลคูณของปริมาตร 2 คูณแรงดัน 2 และความสัมพันธ์นี้ยังคงที่
ตัวอย่างของกฎหมาย Boyle-Mariotte
ตัวอย่าง 1. คำนวณปริมาตรที่ก๊าซจะครอบครองซึ่งมีปริมาตร 3.75 ลิตรที่แรงดัน 2 ที่หากใช้แรงดัน 3.5 ที่
วี1 = 3.75 ลิตร
พี1 = 2 ที่
วี2 = ?
พี2 = 3.5 ที่
อย่าง วี1พี1 = ว2พี2 = k
เราคำนวณค่าคงที่ของระบบ:
วี1พี1= k = (3.75) (2) = 7.5
เราแก้หา V2:
วี2 = k / P2 = 7.5 / 3.5 = 2,143 ลิตร
ตัวอย่าง 2. คำนวณแรงดันที่ใช้กับแก๊ส หากมีปริมาตร 2.25 ลิตร ถ้าแรงดัน 1.75 จะมีปริมาตร 3.25 ลิตร
วี1 = 3.25 ลิตร
พี1 = 1.75 ที่
วี2 = 2.25 ลิตร
พี2 = ?
เราคำนวณค่าคงที่ของระบบ:
วี1พี1= k = (3.25) (1.75) = 5.6875
เราแก้ให้ P2:
พี2 = k / V2 = 5.6875 / 2.25 = 2.53 ที่
ตัวอย่างที่ 3. คำนวณความดันเดิมของแก๊ส ถ้าใช้แรงดัน 4.5 at จะมีปริมาตร 1.4 ลิตร และปริมาตรเดิมคือ 2.2 ลิตร
วี1 = 2.2 ลิตร
พี1 = ?
วี2 = 1.4 ลิตร
พี2 = 4.5 ที่
เราคำนวณค่าคงที่ของระบบ:
วี2พี2= k = (1.4) (4.5) = 6.3
เราแก้ให้ P2:
พี1 = k / V1 = 6.3 / 2.2 = 2.863 ที่