ความหมายของอัตราการเกิดปฏิกิริยา
เบ็ดเตล็ด / / July 04, 2021
โดย ฟลอเรนเซีย อูชา เมื่อวันที่ 2 ก.พ. 2014
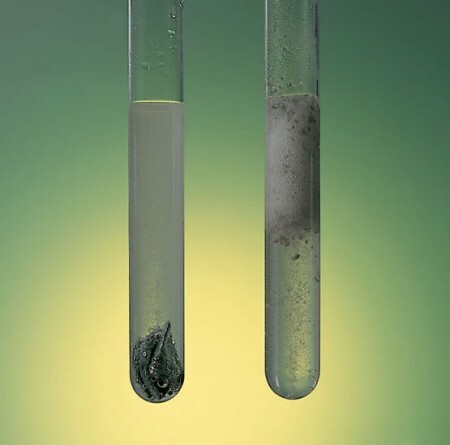 แนวคิดของ ความเร็ว ปฏิกิริยา กำหนด ปริมาณของสารที่ถูกแปลงในปฏิกิริยาที่กำหนด ต่อหน่วยปริมาตรและเวลา. ดังนั้น ปฏิกิริยาของวัสดุ เช่น เหล็ก จะช้ากว่ามากและจะใช้เวลาหลายปีกว่า การเปรียบเทียบ กับ การเผาไหม้ ของก๊าซบิวเทนตามคำสั่งของไฟซึ่งจะผลิตในเวลาเพียงไม่กี่วินาที
แนวคิดของ ความเร็ว ปฏิกิริยา กำหนด ปริมาณของสารที่ถูกแปลงในปฏิกิริยาที่กำหนด ต่อหน่วยปริมาตรและเวลา. ดังนั้น ปฏิกิริยาของวัสดุ เช่น เหล็ก จะช้ากว่ามากและจะใช้เวลาหลายปีกว่า การเปรียบเทียบ กับ การเผาไหม้ ของก๊าซบิวเทนตามคำสั่งของไฟซึ่งจะผลิตในเวลาเพียงไม่กี่วินาที
ในขณะเดียวกันมันจะเป็น จลนพลศาสตร์เคมี, พื้นที่นั้นภายใน เคมีกายภาพ ผู้รับผิดชอบการศึกษา ความเร็ว ของปฏิกิริยาและเมื่อเงื่อนไขตัวแปรบางอย่างปรับเปลี่ยนความเร็วของปฏิกิริยาของวัสดุหรือสาร และรวมถึงเหตุการณ์ระดับโมเลกุลที่เกิดขึ้นในปฏิกิริยาทั่วไปด้วย ในขณะเดียวกันมันจะเป็น พลวัตทางเคมี ที่เกี่ยวข้องกับการศึกษาที่มาของความเร็วของปฏิกิริยาประเภทต่างๆ
ควรสังเกตว่าฟิลด์เช่นฟิลด์ของ วิศวกรรมเคมี, วิศวกรรมสิ่งแวดล้อม และเอนไซม์ ใช้จลนพลศาสตร์ทางเคมีในกระบวนการของพวกเขา
มีหลายอย่าง ปัจจัย ที่มีอิทธิพลต่อความเร็วของปฏิกิริยาและจำเป็นต้องเขียนรายการให้รู้ว่ามันส่งผลต่อปฏิกิริยาอย่างไร ...
ธรรมชาติ ของปฏิกิริยามีความเด็ดขาดเนื่องจากมีปฏิกิริยาบางอย่างที่โดยธรรมชาติแล้วสามารถเร็วกว่าปฏิกิริยาอื่นและในทางกลับกัน ปริมาณของสปีชีส์ที่ทำปฏิกิริยา สถานะทางกายภาพของอนุภาคและ
ในทางกลับกัน ยิ่งสูง ความเข้มข้น อัตราการเกิดปฏิกิริยาเร็วขึ้น
ความดันในส่วนของมันยังส่งผลต่อความเร็วของปฏิกิริยา ดังนั้นความเร็วของปฏิกิริยาก๊าซจะเพิ่มขึ้นอย่างเห็นได้ชัดด้วยแรงดัน ซึ่งเกือบจะเหมือนกับการเพิ่มความเข้มข้นของก๊าซ
การสั่งซื้อสินค้า ของปฏิกิริยายังมีอิทธิพลเนื่องจากคำสั่งควบคุมว่าความเข้มข้นส่งผลต่ออัตราการเกิดปฏิกิริยาที่เป็นปัญหาอย่างไร
และในที่สุดก็ อุณหภูมิมีความสำคัญเพราะเมื่อทำปฏิกิริยาที่อุณหภูมิสูงมาก มันจะให้มากกว่า พลังงาน กับระบบและด้วยเหตุนี้ความเร็วของปฏิกิริยาจะเพิ่มขึ้นทำให้เกิดการชนกันของอนุภาคมากขึ้น
หัวข้อในความเร็วปฏิกิริยา


