Moleküler Geometrinin Tanımı
Çeşitli / / January 11, 2022
kavramsal tanım
Uzayda kendisini oluşturan atomların üç boyutlu dizilişini belirleyen bir molekülün yapısıdır.

Kimya Mühendisi
Moleküler geometriler şu anda aşağıdakilere dayalı olarak tanımlanmaktadır: teori Valensiya Katmanının Elektronik Çiftlerinin (TRPECV) İtmesi. Bu teori, davranışın tahmin edilmesini sağlar. kimyasal maddelerin (özellikle kovalent) ve anlaşılmasına yardımcı olur dağıtım elektronik, yol açan geometri arasında molekül. Bu da, maddelerin elde ettiği birçok özelliği anlamamızı sağlar.
Bu Teori, gözden geçireceğimiz ve daha sonra bunları anlamaya çalışacağımız bir dizi temel sütuna dayanmaktadır. uygulama uygulama. İlk olarak, bağlı ve bağlı olmayan (değerlik) elektronlar, bir elektron denizi olarak düşünülür, aynı tür yüke sahiplerse, birbirlerini iterler, bu nedenle her zaman atomun merkez atomundan olabildiğince uzakta bulunurlar. molekül.
İkincisi, elektronların bu "deniz"i veya "elektronik bulut", yüksek elektron yoğunluklu alanlar oluşturur, elektronların paylaşıldığı bağlarda veya paylaşılmayan elektron çiftlerinde oluşanlar. Buna karşılık, oluşan bağlar tekli, ikili ve hatta üçlü olabilir.
Son olarak, karar vermek Moleküler geometri, merkezi atom etrafındaki elektron yoğunluklarının sayılacağı Lewis yapısına sahip olmak çok yararlıdır ve bu gösterge geometrisinin adından ve molekülün üç boyutlu olarak aldığı şeklinden.
Unutulmamalıdır ki, en kararlı yapıyı benimsemek ve daha az itmenin olduğu yerlerde bu yoğunluklar mümkün olduğunca ayrı yerleştirilecektir. Bu şekilde önce elektronik geometri, ardından moleküler geometri belirlenir.
Altı yoğunluk seviyesi
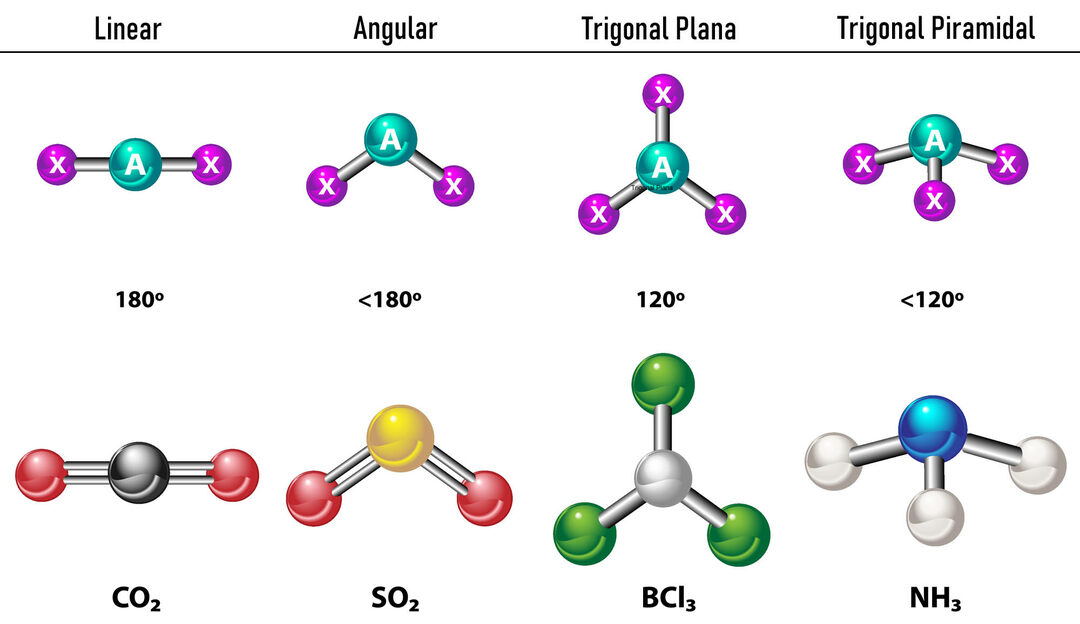
Merkez atomun çevresinde iki elektron yoğunluğu olması durumunda, bağlar birbirinden olabildiğince uzakta yer alacaktır. aralarında, yani birbirinden 180º uzaktadır ve bu nedenle elektronik geometrileri lineer ve moleküler olarak da lineerdir.
Merkez atomun çevresinde üç elektron yoğunluğu olması durumunda iki seçenek vardır: üç bağ veya iki bağ ve bir bağlanmamış çift. Üç bağ varsa, elektronik geometri Üçgen Daire, bağlar arasındaki 120º açı ile moleküler geometri ile aynı adı alır. Şimdi, eğer bağlı olmayan bir çift varsa, birbirlerini daha fazla iterler. yoğunluk bağlı yükler bu nedenle bağ açılarını sıkıştırma eğilimindedir. Serbest çift ile her bağ arasındaki açı 120º'dir ve elektronik geometrisi Üçgen Düzlem, moleküler geometri ise Açısaldır.
Merkez atomun etrafında dört elektron yoğunluğu olması durumunda, elektronik geometri tetrahedraldir. Dört elektron çiftinin tümü bağlıysa, moleküler geometrileri elektronik geometrileriyle örtüşür ve bağ açısı 109,5º'dir. Şimdi, çiftlerden biri serbest ise bağ açısı küçülür (107º) ve moleküler geometri tiptir. üçgen piramit. Son olarak, ikisi serbest çift ve ikisi bağlıysa, moleküler geometri denirken bağ açısı 104,5º'dir. Açısal.
Merkez atomun etrafındaki elektron yoğunlukları beşe ulaştığında buna a denir. Üçgen Bipiramit elektronik geometrisi. Tüm yükler bağlı ise, ekvatoral bağlantılar arasında 120ºC, eksenel ile ekvatoral bağlantılar arasında 90º açı vardır. Şimdi, moleküler geometri aynı zamanda Trigonal Bipiramid olarak da adlandırılırken, dört bağlantılı çift ve bir serbest çifte sahip olduğundan, moleküler geometri çarpıtılarak iyi bilinen "rockçı”, Orada aldığı isim çarpık tetrahedron. Oysa, beş elektron çiftinden ikisi serbest ve üçü de bağlı ise, “T” şeklinde bir geometriye sahiptir ve tam olarak yapısından dolayı adını alır. Son olarak, eğer tersi ise, üç serbest çift ve iki bağlı yük ise, moleküler geometri lineerdir.
Son olarak, merkezi atomun etrafında altı elektron yoğunluğu vardır ve bir oktahedron oluşur, bu nedenle elektronik geometrideki adıdır. Benzer şekilde, tüm çiftleri birbirine bağlıysa moleküler geometri de adlandırılır. Beş bağlantılı çiftiniz ve bir serbest çiftiniz varsa, moleküler geometri Kare Tabanlı Piramit'tir. Dört bağlı çiftiniz ve iki serbest çiftiniz varsa, moleküler geometri Kare Daire.
Şekil: Tatlı Doğa
Moleküler Geometri Konuları