Tanım ABC Kavramı
Çeşitli / / April 22, 2022
kavram tanımı
Azeotroplar, belirli sıcaklıklarda kaynayan, belirli bir bileşime sahip kimyasal bileşiklerin karışımlarıdır. Temel özelliği, karışımın tek bir saf madde gibi davranması, özelliklerini koruması ve kullanım kolaylığı sağlamasıdır.

Kimya Mühendisi
Karışım iki veya daha fazla bileşenle verilebilir ve kompozisyon hem sıvı fazda hem de gaz fazda aynıdır, bu saf maddelerle benzerlikler oluşturur. Buradan, bu karışımın aşağıdaki gibi işlemlerle bileşenlerine ayrılamayacağı kolayca çıkar. fraksiyonel damıtma, çünkü yukarıda belirtildiği gibi, orantılarını koruyacak, tek bir şeymiş gibi davranacaktır. bileşen.
Diğer bir özellik, bu karışımın kaynama noktasının bileşenlerinden birinin kaynama noktasının daha yüksek, daha düşük veya hatta eşit olabilmesidir. Azeotrop bir sıcaklıkta kaynadığında hava sıcaklığı maksimum kaynama maksimum azeotrop olarak bilinir ve bunu mümkün olan en düşük sıcaklıkta yaptığında minimum azeotrop olarak bilinir. Bu, minimum azeotropun saf bileşenlerinden daha düşük bir kaynama noktasına sahip olduğu ve maksimum azeotropta bunun tersi olduğu anlamına gelir. Örneğin metanol - benzen karışımında azeotrop minimumdur (fraksiyonlarda 0.61 benzen - 0.39 metanol) molar) kaynama noktası 58 °C olan, benzenin kaynama noktasının 80 °C ve metanolün kaynama noktasının olduğu bir tankta 65 °C
Minimum ve maksimum azeotroplar
Şimdi… bir azeotrop nereden geliyor? Bir sapma olduğunda Yasa Raoult, yani azeotropik karışımın buhar basıncı, molar fraksiyonu ile doğrudan ilişkili değildir, azeotropik karışım kavramı ortaya çıktığında ortaya çıkar. Bu sapmalar, bileşenler birbirini önemli ölçüde çektiğinde veya ittiğinde, yani moleküller arası kuvvetler farklı bileşiklerde çok farklı olduğunda meydana gelir.
Sapma pozitif olduğunda minimum azeotropu elde ederiz, sapma negatif ise maksimum azeotropu elde ederiz. Bu kavramı daha iyi anlamak için bazı grafiklere bakalım:
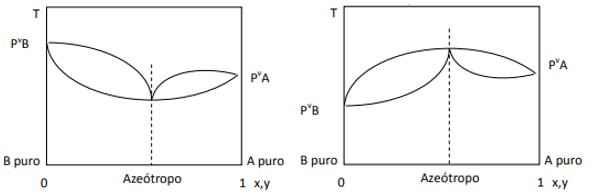
Burada, eğer karışım Raoult Yasasına göre ideal olsaydı, saf bileşenlerin buhar basınçlarının düz bir çizgi ile birleştirilmesi gerektiğini gözlemliyoruz, çünkü arasında daha büyük veya daha az yakınlık olup olmadığına bağlı olarak, minimum ve maksimum azeotropların oluşumuna neden olan bu yasadan bir sapma vardır. bileşenler. Raoult yasasından sapma, soldaki şekilde olduğu gibi negatif olduğunda, minimumdur. diyagram basınç, ancak sıcaklık diyagramında bir maksimum (dolayısıyla, maksimum azeotrop). Öte yandan, eğer sapma Raoult Yasasına göre pozitifse, basınç ve basınçta maksimum olacaktır. bileşim, ancak sıcaklık ve sıcaklık diyagramında minimumdur. kompozisyon (burada minimum azeotropumuz var). Basınç ve basınç diyagramlarını karıştırmayın. bileşim ve sıcaklık vs. kompozisyon.
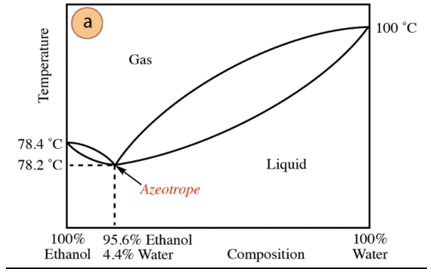
Etanol-su karışımı durumunda, bileşimi %95.6 etanol ve %4.4 su olan minimum bir azeotrop vardır. Azeotropik karışımın kaynama sıcaklığı, saf bileşenlerinkinden 78,2 °C daha düşüktür. Bu nedenle, yüksek su içeriğine sahip (%100'e yakın) bir su-etanol karışımının damıtıldığını varsayalım. Her damıtma aşamasında daha büyük fraksiyonlar elde edileceğinden saf alkol elde etmek mümkün olmayacaktır. etanol, ancak hiçbir zaman %100'e ulaşmadığında, yavaş yavaş azeotropik karışımın bileşimine yaklaşacaktır (en düşük nokta altında). Bu nedenle su gibi minimum azeotrop oluşturma eğilimindedir. organik bileşikler (etkileşen moleküller arası kuvvetlerin türü göz önüne alındığında), saf bileşiği elde etmek için önceden suyu karışımdan çıkarmak gerekir. Veya, azeotrop elde edildiğinde, yöntemleri çıkarma ilave su.
Yukarıdakilere dayanarak, alkol bulmak tesadüf değildir (süpermarkette ve eczane) %95 ile elde edilebilecek en ucuz üründür. Saf alkol elde etmek için azeotropu "kırmak" gerekir. teknik ek, örneğin kurutma ajanlarının veya azeotropik damıtmaların kullanılması. Azeotropik damıtma, karışıma sürüklenme ve etkileşim karışımın herhangi bir bileşeni ile (yüksek afinite) karışımdan çıkarılabilir.
Azeotroplarda Konular