25 Halojenür Örnekleri
Örnekler / / November 09, 2023
A halojenür veya halojenür bu bir kimyasal bileşik bir ikiliden oluşan atom bir halojen ile halojeninkinden daha düşük elektronegatifliğe sahip bir element veya katyonun birleşimidir. Örneğin:
- Sodyum klorür (NaCl)
- Kalsiyum florür (CaF2)
- Potasyum bromür (KBr)
- Hidrojen klorür (HCl(G))
Halojenler kimyasal elementler 17. grubu oluşturanlar Periyodik tablo. Halojenler şunlardır: Flor (F), Klor (Cl), Brom (Br), İyot (I), Astatin (At), Teneso (Ts).
- Ayrıca bakınız: Aldehitler ve ketonlar
Halojenür türleri
Bileşimlerine bağlı olarak halojenürler şunlar olabilir:
- İnorganik halojenürler. Bir veya daha fazla halojen atomu içeren inorganik kimyasal bileşiklerdir. İnorganik tuzlar, hidrojen halojenürler veya metal kompleksleri olabilirler. Örneğin: sodyum klorür (NaCl) ve tetraiyodomerkürat anyonu HgI42-.
- Organik halojenürler. Organik bir bileşiğin karbon atomuna bağlı bir veya daha fazla halojen atomu içeren organik kimyasal bileşiklerdir. Örneğin: metil klorür (CH3 – Cl) ve triklorometan (CH – Cl)3).
Halojenür örnekleri
- Sodyum klorür (NaCl)
- Kalsiyum klorür (CaCl2)
- Gümüş florür (AgF)
- Lityum florür (LiF)
- Potasyum iyodür (KI)
- Potasyum bromür (KBr)
- Bakır(II) klorür (CuCl2)
- Demir(III) klorür (FeCl3)
- Krom(III) bromür (CrBr3)
- Alüminyum klorür (AlCl3)
- Amonyum klorür ((NH4)CI)
- Kurşun(II) iyodür (PbI2)
- Magnezyum iyodür (MgI2)
- Berilyum florür (BeF2)
- Alüminyum florür (AlF3)
- Bromometan (CH3 – kardeşim)
- İyodoform (CHI3)
- Metil klorür (CH3 –Cl)
- Bromoetan (CH3 – CH2 – kardeşim)
- Dikloroetan (Cl – CH2 – CH2 –Cl)
- Gümüş bromür (AgBr)
- Kalay(IV) klorür (SnCl4)
- Titanyum(IV) klorür (TiCl4)
- Hidrojen klorür (HCl(G))
- Hidrojen bromür (HBr(G))
Halojenürlerin fiziksel özellikleri
Halojenürlerin bazı fiziksel özellikleri şunlardır:
- Alkil halojenürler (organik halojenürler), karşılık gelen alkanlardan daha yüksek yoğunluklara ve kaynama noktalarına sahiptir. Bunun nedeni halojen atomunun hidrojen atomunun yerini almasıdır. hidrokarbon halojenürün geldiği yer.
- Organik florürler ve klorürler sudan daha az yoğundur, organik bromürler ve iyodürler ise sudan daha yoğundur.
- Alkil halojenürler suda çözünmez ve organik çözücülerde çözünür.
- Hidrojen halojenürler oda sıcaklığında yoğun kokuya sahip gazlardır.
- Periyodik Tablonun 1. grubundaki elementlerin atomlarından oluşan halojenürler beyaz katılardır.
Halojenürlerin kimyasal özellikleri
- Alkil halojenürler alifatik nükleofilik ikame reaksiyonlarına girer. Bunlar, nükleofilik bir atomun (elektron bakımından zengin), elektrofilik bir atoma (elektron bakımından yetersiz) bağlı bir atomun (çıkış grubu) yerini aldığı reaksiyonlardır.
Örneğin: metil bromürün reaksiyonunda ( CH3 – Br) sodyum hidroksit (NaOH) ile, metil bromürde bromin (ayrılan grup), karbonun elektrofil olduğu hidroksit iyonu (nükleofil) ile değiştirilir.
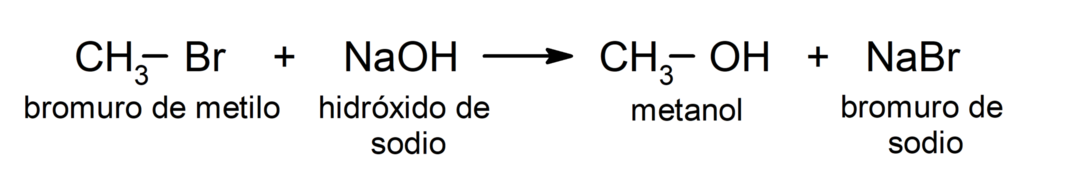
- Bazı alkil halojenürler, eter veya tetrahidrofuran gibi çözücüler içerisinde magnezyum ile reaksiyona girer ve ortaya çıkan ürün, "Grignard reaktifi" adı verilen organometalik bir bileşiktir. Örneğin: etil bromür (CH3 – CH2 – Br) magnezyum (Mg) ile etilmagnezyum bromür (CH) üretmek için kuru bir ortamda reaksiyona girer3 – CH2 – MgBr).

- Birincil alkil halojenürler alkoksitlerle reaksiyona girer veya alkoller eter üretmek için temel ortamda. Bu reaksiyonlar “Williamson sentezi” olarak bilinir. Örneğin: metil bromür (CH) arasındaki reaksiyon3Br) ve sodyum metoksit (CH3ONa) dimetil eter (CH) üretir3OCH3).
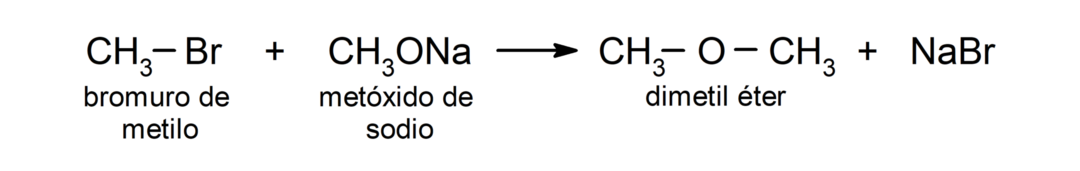
Halojenürlerin kullanım alanları
Halojenürler veya halojenürlerin endüstride, tıpta ve günlük yaşamda çeşitli uygulamaları vardır. Bu uygulamalardan bazıları şunlardır:
- Birçokları için çözücü olarak kullanılırlar. organik bileşikler.
- Dezenfektan ve antiseptik olarak kullanılırlar.
- Soğutucu olarak kullanılmışlardır.
- Florlu polimerlerin üretiminde kullanılırlar. Örneğin Teflon.
- Tıpta yenilebilir tuzlar veya tentürler olarak kullanılırlar.
- Su arıtma ve saflaştırmada kullanılırlar.
- Lambaların üretiminde metal halojenürler kullanılır.
- Elektronik bileşenlerin temizliğinde kullanılırlar.
- Daha karmaşık organik bileşiklerin sentezlenmesinde başlangıç kimyasalları olarak kullanılırlar.
- Gümüş bromür (AgBr) gibi bazıları fotoğraf plakalarının geliştirilmesinde kullanılır.
Halojenürlerin tehlikeleri
Çözücü olarak kullanılan alkil halojenürler, güçlü bazlar ve güçlü oksidanlarla şiddetli reaksiyona girerek patlamalara ve yangınlara neden olabilir.
Ek olarak, kloroflorokarbonlar (CFC'ler), onlarca yıldır soğutucu olarak kullanılan alkil halojenürlerdir, ancak bunların İstihdam, uluslararası kuruluşlar tarafından yasaklanmıştır, çünkü bu katmandaki boşluktan esas olarak onlar sorumludur. ozon.
Öte yandan hidrojen halojenürler gözleri, cildi ve mukoza zarlarını tahriş eder.
Şununla takip edin:
- Sen dışarı çık
- asit tuzları
- nötr tuzlar
Referanslar
- SALOMONLAR, T. G. (1996). Organik Kimyanın Temelleri. Wiley.
- Whitten, K. W., Gailey, K. D., Davis, R. E., de Sandoval, M. T. İLE. O. ve Muradás, R. M. G. (1992). Genel Kimya (s. 108-117). McGraw-Hill.
- Wells, A. F. (1978). Yapısal inorganik kimya. Geri al.



