Halojenlerin Özellikleri
Kimya / / July 04, 2021
Halojenler, periyodik tablonun VIIA veya 17. grubunda yer alan kimyasal elementlerdir. Flor, klor, brom, iyot ve astat elementlerinden oluşur.
Halojen adı Yunancadan gelir ve "tuz üreticisi" anlamına gelir, çünkü bu elementler ortak tuza benzer sodyum ile tuzlar oluşturur.
Halojenlerin ortak özellikleri:
Tek değerli elementlerdir, yani sadece bir değerlik numarasına sahiptirler. Halojenlerde değerlik -1'dir.
Hidrojene afiniteleri vardır ve sözde hidrasitleri oluştururlar.
Oksijene afiniteleri azdır, bu nedenle oksit oluşturmazlar, ancak çok yüksek sıcaklıklardadırlar.
Halojen tuzları oluşturmak için metallerle birleşirler.
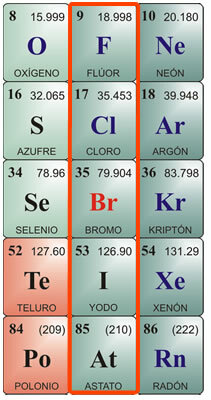
Halojenlerin bireysel özellikleri:
Flor Özellikleri:
Kimyasal sembol F. Atom numarası 9, atom ağırlığı 19. Saf halde flor, erime noktası -223 °C ve kaynama noktası -187 °C olan sarı bir gazdır. Doğada özgür değildir, bu yüzden izole edilmelidir. İlk olarak 1886'da izole edildi. Fiziksel özellikleri: Yeşilimsi sarı gaz, Çok aşındırıcı ve tahriş edici, keskin kokulu, insanlar ve hayvanlar için zehirlidir. Sıvılaştırmak zordur. Kimyasal özellikler: Çok düşük sıcaklıklarda bile ekzotermik reaksiyonla hidrojen ile birleşir. Metallerle birleşerek tuzları oluşturur. Hidroklorik asidi ayrıştırarak klor üretir ve suyu ayrıştırarak oksijen açığa çıkarır. Hidrojene olan afinitesinden dolayı organik maddelerden alır, onları karbonize eder. Ana bileşiklerinden biri, camdaki silikaya saldırdığı için yalnızca platin veya mum kavanozlarında saklanabilen hidroflorik asittir. Çok uçucu ve çok aşındırıcıdır. Metallerle birleştiğinde florür üretir.
Klor Özellikleri:
Kimyasal sembol Cl Atom numarası 17, atom ağırlığı 35.5. Erime noktası - 102 °C, kaynama noktası -37 °C Klor 1774'te keşfedildi ve 1811'de izole edildi. Fiziksel özellikler: Genellikle tuzlarda bir arada bulunduğundan doğada serbest halde bulunmayan yeşilimsi sarı bir gazdır. Boğucu ve zehirli bir kokusu vardır. Kimyasal özellikler: Klor, hidroklorik asit üretmek için ekzotermik bir reaksiyonda birleşerek hidrojene çok benzer. Muriatik asit veya dumanlı tuz olarak da adlandırılan hidroklorik asit, antik Roma'dan beri biliniyordu. Volkanlarda gaz halinde bulundu ve volkanların yakınındaki bazı nehirlerin sularında çözündü. Cilt için çok aşındırıcıdır ve yutulduğunda zehirlidir. Sindirim için mide tarafından üretilir. Diğer önemli klor bileşikleri hipokloritler, özellikle suda çözündüğünde su ağartıcı, dezenfektan ve sterilan olarak kullanılan sodyum hipoklorittir. Asitleri nötralize eder.
Brom özellikleri:
Kimyasal sembol Br. Atom numarası 35, atom ağırlığı 79.9. Erime noktası -7.3 °C, kaynama noktası 58.8 °C Doğada serbest halde bulunmaz, ancak metallerle birleşerek bromürler oluşturur. Elektroliz ile izole edilir. Fiziksel özellikler: Tahriş edici bir kokuya sahip koyu kırmızı bir sıvıdır; oda sıcaklığında tahriş edici yoğun turuncu-kırmızı buhar çıkararak öksürüğe ve yırtılmaya neden olur; Zehirlidir. Eter veya kloroformda çözünür ve suda çok az çözünür. Kimyasal özellikler: Brom organik maddeye saldırır; canlılarda cildi aşındırır ve iyileşmesi zor ülserlere neden olur. Ana kullanımı, eskiden fotoğrafçılıkta kullanılan gümüş bromür gibi endüstriyel kullanımlar için kullanılan bromürleri oluşturan metallerle birleştirilir. Ayrıca antiseptik olarak düşük konsantrasyonlarda kullanılırlar. Hidrojen ile birleştiğinde, esas olarak metallere saldırmak ve bromür elde etmek için kullanılan keskin bir koku ve tada sahip renksiz bir gaz olan hidrobromik asit ile sonuçlanır.
Özellikleri İyot:
Kimyasal sembol I. Atom numarası 53, atom ağırlığı 126.9. Erime noktası 113 ° C; kaynama noktası 184 ° C Doğada serbest halde bulunmaz. Deniz yosunu yataklarında iyodür olarak ve su teresi, morina yağı ve kabuklu deniz ürünleri gibi bazı gıdalardaki minerallerin bir parçası olarak bulunur. Fiziksel özellikler: İyot, güçlü ve hoş olmayan bir kokuya sahip, metalik bir parlaklığa sahip, siyahımsı gri renkli, katı, kristal bir gövdedir. Suda az çözünür ve alkolde çok çözünür. Kimyasal özellikler: İyodür oluşturan metallerle birleşir; ayrıca kükürt ve fosfor gibi metaloidlerle. Diğer halojenlere göre oksijene afinitesi daha yüksektir. Amonyak ile birleştiğinde patlayıcı bir gaz olan nitrojen iyodür üretir. Hidrojen ile birleştiğinde, havanın varlığında sigara içen keskin bir koku ve tada sahip renksiz bir gaz olan hidroiyodik asit üretir. Suda çözünür ve ışık ve ısı etkisi altında ayrışır. Asit molekülü oksijen içeriyorsa, oksitleyici özelliklere sahip kristal bir katı olan iyoik asit üretilir. İyot, alkollü solüsyonda dezenfektan ve antiseptik olarak kullanılır.
Özellikleri durum:
Sembolde. Atom numarası 85, atom ağırlığı 210. Doğada serbest halde bulunmaz. Erime noktası 254 ° C; kaynama noktası 962 ° C Astatin, bizmut atomlarının alfa ışınları tarafından parçalanmasından salınan bir element olduğu için ilk olarak 1940'larda sentezlendi. Ömrü çok kısa olan radyoaktif bir elementtir; en uzun süren izotop, yaklaşık 8 saatlik bir maksimum ömre sahip At210'dur. Kimyasal özelliklerinin iyodine çok benzer olduğu kabul edilir; fiziksel olarak metallerinkine daha çok benzeyen bir görünüme ve özelliklere sahip olabilirdi. Radyoaktif bir element olmasına rağmen normalde doğada bulunmadığı için sağlığa zararlı değildir. Atom altı madde çalışmasında atomların etiketlenmesi için laboratuvarda sadece birkaç uygulaması vardır.



