Kovalent Bağ Örneği
Kimya / / July 04, 2021
Kovalent bağ olduğu iki atom elektronlarını paylaşarak birleşir, Octet Kurallarını tamamlamak için.
Kovalent Bağın Tarihi
20. yüzyılın başlarında kimyagerler moleküllerin nasıl ve neden oluştuğunu anlamaya başladılar. İlk büyük atılım şu teklifle geldi: gilbert lewis ne hakkında kimyasal bağ oluşumu ima ediyor ki atomlar elektronları paylaşır. Lewis, Hidrojende kimyasal bağ oluşumunu şu şekilde tanımladı:
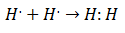
Bu tür elektron eşleşmesi, içinde bulunduğu bir bağ olan Kovalent Bağın bir örneğidir. iki elektron iki atom tarafından paylaşılır. Kovalent Bileşikler onlar bu sadece kovalent bağlar içerir.
Kovalent Bağdaki Elektronlar
Basitlik için, paylaşılan elektron çifti genellikle olarak temsil edilir tek satır elemanların sembollerini birbirine bağlar. Böylece Hidrojen molekülünün kovalent bağı H-H olarak yazılır.
Kovalent bağda, paylaşılan çiftin her elektronu her iki atomun çekirdeğine çekilir. Bu çekim, H molekülündeki iki atomu bir arada tutar.2 ve diğer moleküllerde kovalent bağların oluşumundan sorumludur.
Birkaç elektronun atomları arasındaki kovalent bağlarda sadece değerlik elektronları katılır, en dıştaki, en sığ yörüngede. Bir ile üç arasında birliğe katılacak.
Bağa katılmayan diğer elektronlara denir. Bağ Yapmayan Elektronlarveya onları çiftler halinde düzenlersek, Ücretsiz Çiftler. Yani, Valencia Elektron çiftleri Kovalent Bağ Oluşumuna katılmaz.
Kovalent Bağ Temsil
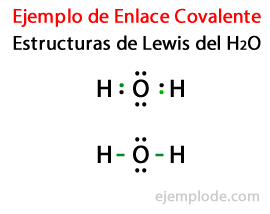
H gibi kovalent bileşiklerin temsil edildiği yapılar2 ve F2 olarak bilinir Lewis yapıları. Bir Lewis yapısı bir bir kovalent bağın temsili, burada paylaşılan elektron çifti çizgilerle veya iki atom arasındaki nokta çiftleri olarak gösterilirve paylaşılmamış serbest çiftler, tek tek atomlar üzerindeki nokta çiftleri olarak gösterilir. Bir Lewis yapısında, dahili olanlar değil, yalnızca değerlik elektronları gösterilir.
Su molekülü H için Lewis yapısı göz önüne alındığında2Veya Hidrojen ve Oksijen atomlarının tüm değerlik elektronları önce noktalarla işaretlenir.
İkinci durumda, bağlantı bir çizgi ile işaretlenmiştir. Ve sadece Oxygen'de var olacak ücretsiz çiftler, puanlarla.
Sekizli Kuralı
Bu moleküllerin oluşumu, Su H'dekiler gibi2Veya aramayı gösterin sekizli kuralıLewis tarafından önerildi: Hidrojen dışındaki bir atom, kendisini çevreleyene kadar bağ oluşturma eğilimindedir. sekiz değerlik elektronuYani, her bir atomun oktetini tamamlaması için yeterli elektron olmadığında bir kovalent bağ oluşur.
Kovalent bir bağda elektronları paylaşarak, her atom oktetini tamamlar. Hidrojen için gereklilik, toplam iki elektrona sahip olacak şekilde Helyum'un elektronik konfigürasyonunu elde etmenizdir.
Oktet kuralı esas olarak çalışır periyodik tablonun ikinci periyodu veya satırının elemanları için. Bu elementler, toplam sekiz elektronun bulunabileceği alt seviyelere sahiptir.
Bu elementlerin bir atomu bir Kovalent Bileşik oluşturduğunda, aynı bileşikteki diğer atomlarla elektronları paylaşarak Neon Soy Gazın elektronik konfigürasyonunu elde eder.
Kovalent Bağ Türleri
Atomlar farklı türlerde Kovalent Bağlar oluşturabilir: Tekler, Çiftler veya Üçler.
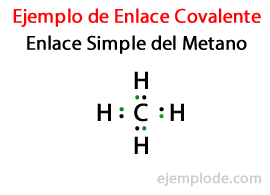
İçinde Basit Bağlantı, iki atom aracılığıyla birleştirilir Bir Çift Elektron. Kovalent bileşiklerin büyük çoğunluğunda bulunurlar ve bu bağın en temel şeklidir.
Birçok bileşikte, Çift Bağlantı, yani, iki atom paylaştığında İki Çift Elektron. İki atom iki çift elektronu paylaşıyorsa, kovalent bağa çift bağ denir. Bu bağlar, Karbon Dioksit (CO) gibi moleküllerde bulunur.2) ve Etilen (C2H4).

bir Üçlü Bağlantı iki atom paylaştığında ortaya çıkar Üç Çift Elektron, nitrojen molekülünde olduğu gibi N2, Asetilen C molekülü2H2.

Çoklu bağlar, tekli kovalent bağlardan daha kısadır. Bağlantı uzunluğu olarak tanımlanır birleştirilmiş iki atomun çekirdeği arasındaki mesafe bir molekülde bir kovalent bağ ile.
Kovalent ve İyonik Bileşikler Arasındaki Farklar
İyonik ve kovalent bileşikler, bağlarının farklı nitelikte olması nedeniyle genel fiziksel özelliklerinde belirgin farklılıklar gösterir.
İçinde Kovalent Bileşikler var olmak iki tür çekici güç; onlardan biri bir molekülün atomlarını bir arada tutan. Bu çekiciliğin nicel bir ölçüsü, bağlanma enerjisi. Diğer çekim kuvveti, tam moleküller arasında çalışır ve buna denir. moleküller arası kuvvet. Moleküller Arası Kuvvetler genellikle bir molekülün atomlarını bir arada tutan kuvvetlerden daha zayıf olduğundan, kovalent bir bileşiğin molekülleri daha az kuvvetle bağlanır.
Sonuç olarak, kovalent bileşikler neredeyse her zaman düşük erime noktalı gazlar, sıvılar veya katılardır.n. Öte yandan, iyonları bir arada tutan elektrostatik kuvvetler iyonik bir bileşikte genellikle çok güçlüdürler, böylece iyonik bileşikler oda sıcaklığında katıdır ve yüksek erime noktalarına sahiptir. Birçok iyonik bileşik suda çözünür ve bunların sulu çözeltileri elektriği iletir çünkü bu bileşikler güçlü elektrolitlerdir.
Çoğu kovalent bileşikler suda çözünmezve eğer çözülürlerse, sulu çözeltileri her zaman oldugu gibi elektriği iletmezler çünkü bu bileşikler elektrolit değildir. Erimiş iyonik bileşikler, serbestçe hareket eden katyonlar ve anyonlar içerdiklerinden elektriği iletirler; sıvı veya erimiş kovalent bileşikler, iyon bulunmadığından elektriği iletmezler.
Kovalent Bağlı Bileşiklerin Örnekleri
- asetilen C2H2
- metan CH4
- etan C2H6
- propan C3H8
- Bütan C4H10
- Benzen C6H6
- Toluen C7H8
- Metil Alkol CH3Ah
- Etil Alkol C2H5Ah
- Propil Alkol C3H7Ah
- Metil Eter CH3OCH3
- Metil Etil Eter C2H5OCH3
- Etil Eter C2H5OK2H5
- Formik Asit HCOOH
- Asetik Asit CH3COOH
- Propiyonik Asit C2H5COOH
- Bütirik Asit C3H7COOH
- Karbon Dioksit CO2
- Karbon Monoksit CO
- Moleküler azot N2
- Moleküler hidrojen H2

