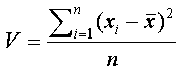Atomaltı Parçacıklar Örneği
Kimya / / July 04, 2021
Atomaltı parçacıklar Onlar Atomu oluşturan küçük birimler. En önemlileri üçtür: Proton ve Nötron Atom çekirdeğini oluşturan ve Elektron, ikincisi etrafında dönen.
Madde, uzayda bir siteyi kapsayan her şey, denilen temel birimlerden oluşur. atomlar. Var olan farklı atomların sayısı, Kimyasal elementler Periyodik Tabloda.
Atomların farklı kombinasyonları bildiğimiz her şeyi oluşturur; Bu kombinasyonlar, her ikisinin de incelenmesinin amacıdır. İnorganik kimya ve Organik Kimya.
Ama aynı zamanda, Atom Çekirdeği ve Elektronlar olarak adlandırılan daha düşük parçacıklardan oluşan temel bir yapıya sahip olmakla çakışan atomların içini de keşfeder.
Atom çekirdeği İki farklı tür parçacıktan oluşur: Protonlar ve Nötronlar.
Protonlar pozitif elektrik yükü taşır (+) ve Nötronlar yük taşımazlar. Negatif yük taşıyan elektronlar (-) Protonların yükü ile etkileşirler ve atomu belirli bir Enerji durumunda tutan bir çekim fenomeni üretilir.
Pozitif ve negatif yükler birbirini tamamen iptal ettiğinde bir atomun Kararlı olduğu söylenir.

Elektron
Normal basınçtaki hava, elektrik akımını çok zayıf iletir. Ancak, bir vakum deşarj tüpünde bulunduğundan, nadir bulunan hava akımı, Katot Işınları adı verilen bir parçacık demeti şeklinde iletir. 1879'da Sir William Crookes, parçacıkların elektrik yükü taşıdığını kanıtladı.
1895'te Jean Perrin, suçlamanın negatif olduğunu doğrulayabildi; ve parçacıklara Elektron adı verildi. Aynı yıl, bir elektrik alanındaki ışınların sapmasını inceleyen Sir J. J. Thompson, Elektronun (e) yükü ile Elektronun kütlesi (m) arasındaki oran olan Özgül Yükün değerini belirledi.
1.7592 * 10 değerinden8 Coulomb / gram "e / m" ve "e" değeri (1.602 * 10)-19 Coulombs), ilk olarak R. İÇİN. Millikan 1917 yılında, Hidrojen atomunun kütlesinin 1/1838'i olan elektronun kütlesini hesapladı.
Elektron Yükü = 1.602 * 10-19 Coulomb'lar
Elektron kütlesi = Hidrojen atomunun kütlesinin 1/1838'i
Elektronun yükünün ilk belirlemeleri Townsend (1897), J. J. Thomson ve H. İÇİN. Wilson (1903), ikincisi C. T. R. Wilson (1897), atom yapısının araştırılmasında yaygın olarak kullanılan bir cihaz olan sis üretmek için.
Elektronlar, Atom'un dış kısmında bulunur ve Güneş'in etrafındaki gezegenlerin yanı sıra Çekirdeğin etrafındaki bir hareketi tanımlar. Çekirdeğin etrafındaki elektron sayısı, onun hangi Kimyasal Element olduğunu söyler.
Örneğin, atomda sadece bir elektron varsa, Element Hidrojendir. 23 elektron varsa, Sodyum'dur. 80 elektron varsa, Element Merkür'dür.

Proton
Delikli bir diskin bir vakum tüpü gibi davrandığı bir vakum tüpünden bir elektrik akımı geçirildiğinde. Katot (negatif elektrot), Katot Işınları (elektronlar) anoda (elektrot) doğru yönlendirilir. pozitif); ancak pozitif yüklü parçacıklar katodun diğer tarafında görünür ve güçlü bir manyetik alan tarafından saptırılabilir.
Bu parçacıkların yükü, pozitif olmasına rağmen, her zaman elektronunkine eşit veya katlarıdır. Pozitif yüklü bir parçacığın kütlesi, tüpte bulunan gazın doğasına göre değişir; genel olarak gaz atomununkine eşittir. Bu parçacıkların demetlerine Pozitif Işınlar denir.
Tüp Hidrojen içeriyorsa, her pozitif parçacık yaklaşık olarak bir Hidrojen atomunun kütlesine sahiptir ve yükü elektronunkine eşit büyüklüktedir. Hidrojen atomu tüm atomların en hafifi ve en basitidir ve ondan elde edilen pozitif ışın parçacıkları tüm pozitif parçacıkların en hafifi ve en basitidir.
Proton Yükü = 1.602 * 10-19 Coulomb'lar
Proton Kütlesi = Hidrojen Atom Kütlesi
Rutherford, bu aynı pozitif parçacığın, Radyum tarafından yayılan ışınlarla farklı elementlerin bombardıman edilmesiyle sıklıkla üretildiğini buldu. Buna daha basit pozitif parçacık adını verdi. Proton, ve Atom'un bir bileşeni olduğu sonucunu çıkardı.
nötronlar
Bugün, bir atomun sayıca Atom Numarasına (elektron sayısı) eşit pozitif elektrik yüklü küçük bir çekirdekten oluştuğu yaygın olarak kabul edilmektedir. çekirdeğin etrafında dönen) tüm Atom için mevcut olan alanın merkezinde veya ona çok yakın ve bahsedilen dış kısmındaki negatif elektronlar Uzay.
Elektronların sayısı, Çekirdekteki pozitif yüklerin sayısıyla çakışır. Hidrojen Atomu hariç, atomun kütlesi, Çekirdeğin yalnızca Protonları değil, aynı zamanda bir dizi nötr parçacık içermesi gerçeğiyle açıklanır. Önceleri nötralize protonlar (her biri bir elektronla birleşmiş) olarak kabul edildiler, ancak bugün kütle ile maddenin temel birimleri olarak kabul edildiler. adlandırılmış nötronlar.
Diğer Atomaltı Parçacıklar
Elektronlara, protonlara ve nötronlara ek olarak, aynı zamanda atomların bileşenleri olarak kabul edilen diğer parçacıklar da günümüzde bilinmektedir. pozitron, Meson veya Mezotron ve nötrino.
pozitronlar Carl Anderson (1932) tarafından kozmik ışınların (radyasyon) etkileşiminde keşfedilmiştir. Uzaydan Dünya'ya ulaşır) madde ile ve belirli radyoaktivite süreçlerinde yapay. Pozitronlar elektronlarla aynıdır, sadece yükleri negatif yerine pozitiftir. Serbest parçacıklar olarak varlıkları son derece küçüktür, saniyenin milyonda birinden daha azdır.
mezonlar Ayrıca Carl Anderson tarafından Seth Neddermeyer (1936) ile işbirliği içinde Kozmik Işınların madde ile hareketiyle keşfedildiler. Bir kütleleri var, sabit değil gibi görünüyor ve yaklaşık olarak Proton'un onda birine eşit ve pozitif veya negatif bir elektrik yükü var. Çok kısa bir ömürleri vardır ve Nötrino artı Elektron veya Pozitron'a ayrışmaları beklenir. İyon hızlandırıcıların kullanımı ile laboratuvarda yapay olarak mezon elde etme girişimi ve bu muazzam enerjileri sağlayan elektronlar (siklotron, betatron, senkrotron, vb.) 1948.
nötrinolar Elektron ve pozitron kütlesine eşit kütleye sahip, ancak elektrik yükü olmayan parçacıklardır. Varlığının 1925'te Fermi tarafından radyoaktif maddeler tarafından Beta Parçacıklarının emisyonundaki belirli enerji hesaplamalarını açıklamak için varsayıldı. Yeni deneyler, nötrinoların varlığıyla mükemmel bir şekilde açıklanabilse de, bunun kesin kanıtı bulunamadı.
Atomaltı Parçacıkların Örnekleri
Proton
Nötron
Elektron
pozitron
Meson veya Mezotron
nötrino
leptonlar
kuarklar
Gluonlar
fotonlar
hadronlar
Graviton (teorik parçacık)