Organik Kimya Örneği
Kimya / / July 04, 2021
Organik Kimya Genel Kimya'nın yapısal elementi kimyasal bileşiklerin incelenmesinden ve fonksiyonel sınıflandırılmasından sorumlu olan bölümüdür. Karbon, bol miktarda mevcut yaşam meselesi; böylece, mineraller olarak sınıflandırılan kimyasal bileşiklere adanmış, İnorganik Kimya'dan oldukça farklı bir evren yaratılır.
Karbon atomunun elektronik konfigürasyonunun son kabuğunda dört elektronu vardır. Bu özellik, atom yarıçapınınkiyle birlikte, diğerlerine kovalent bağlarla bağlanmasına izin verir. Aynı elementin atomları, çok çeşitli kimyasal bileşikler oluşturan çok sayıda zincirde kararlı.
Kontrol edebilirsin Kovalent bağlar.
Bu tür kimyasal bileşikler, onlara ilk yapılarını veren Karbon atomlarına ek olarak, Karbon valansının ana tamamlayıcısı olarak Hidrojen atomlarını içerir. Ayrıca bu bileşik çeşitliliğinde oksijen atomlarının müdahalesiyle olanlar da vardır. Azot, Halojenler, Kükürt ve hatta Fosfor, alkali ve alkali toprak elementleri ve metalleri geçiş. Molekülde kimin yer aldığına bağlı olarak, nihai maddenin fiziksel ve kimyasal özellikleri olacaktır.
organik bileşikler boyunca mevcut yaşam meselesi; hepsini teşvik etmek ve sürdürmek biyolojik fonksiyonlar, insanlar tarafından ticari amaçlarla, deneyler için veya belirli ev içi görevleri yerine getirmek için kullanılan inorganik veya mineral maddelerden farklı olarak.
Organik Kimyanın Tarihi
1828'den önce, Organik Kimya ve İnorganik Kimya arasında zaten ayrım yapılmaktaydı. Organik madde, bir yaratılışla ilişkilendirildi. "hayati kuvvet", ve cansız ile inorganik, mineral ile. Bu kavramlar göz önüne alındığında, laboratuvarda inorganik malzemelerden organik bileşikler elde edilmesi beklenemezdi.
Ancak, 1828'de Friedrich Wöhler (1800-1882) organik bir madde hazırlamayı başardı, Üre CO (NH2)2, inorganik bileşiklerden hayvan metabolizmasının önemli bir ürünü. tedavi Kurşun Siyanat Pb (CNO)2 ile Amonyak NH3 almak Amonyum Siyanat NH4CNO; Bu bileşik gerçekten de oluştu, ancak çözelti Amonyum Siyanatı kristalleştirmek için kaynatıldığında Üre'ye dönüştü.
Bu kimyasal değişim bir örnektir. Dahili yeniden gruplandırmaMoleküldeki atomların sayısı veya sınıfı değişmez, sadece içindeki sıraları değişir. Bu tür dönüşümler organik kimyada çok yaygındır.
Wöhler'in keşfi, daha sonra yaşam gücü teorisinin terk edilmesini başlattı. diğer birçok organik bileşiğin hazırlanmasıyla takip edilerek tamamen atılır. laboratuvar. Buna rağmen, inorganik bileşikler mineral ürünlerle ilgili olduğundan, İnorganik ve Organik niteleyicileri varlığını sürdürür. ve aslında karbon ve hidrojenin bileşikleri ve bunların türevleri olan organik bileşikler, canlı organizmalar tarafından üretilen türdendir.
Genel kimya yasaları her iki bileşiğe de eşit olarak uygulansa da, çeşitli nedenler bu ayrımı haklı çıkarmakta ve zorunlu kılmaktadır. Bu nedenle, organik ve inorganik bileşikler, aşağıdakiler gibi farklı özelliklerde farklılık gösterir: çözünürlük sırasıyla organik çözücülerde (eter, alkol, kloroform vb.) ve suda tercih edilir. istikrar (organik bileşikler nispeten düşük sıcaklıklarda ayrışır) ve Reaksiyonların Karakteri; inorganik bileşikler için iyonik, basit ve pratik olarak anlık, organik bileşikler için ise kovalent, karmaşık ve yavaştırlar.
Organik bileşikler
Doksan atom zincirlerine sahip karbon bileşikleri bilinmektedir. zincirler Karbon atomları olabilir doğrusal ve dallı ve tekli kovalent bağlara veya ikili veya üçlü bağlara sahiptir. 2.500'den fazla bileşiğin yalnızca Karbon ve Hidrojen içerdiği bilinmektedir (hidrokarbonlar).
Organik bileşiklerin izomerizmi
İnorganik bileşiklerde, bir formül genellikle tek bir bileşiği temsil eder; bu nedenle, formül H'nin yalnızca bir maddesi vardır.2GB4. Sülfürik Asit molekülü, özel ve benzersiz bir düzende biri Sülfür ve dördü Oksijen olmak üzere iki Hidrojen atomu içerir. Organik bileşiklerde ise bunun olması nadir. Böylece, örneğin, formül C'ye yanıt veren iki bileşik vardır.2H6Veya, Etil Alkol veya Etanol ve Dimetil Eter.

Molekül ne kadar karmaşıksa, yani Karbon atomlarının sayısı ne kadar fazlaysa, olası izomerlerin sayısı da o kadar fazladır.
Organik Bileşik Analizi
Organik bir bileşiğin analizi şunları içerir: niteliksel analiz, nicel analiz ve Fonksiyonel Analiz. Bileşiğin saf olmayan bir durumda olduğu varsayıldığında, önceden saflaştırılır. kristalizasyon, Damıtma, süblimasyon, çıkarma, vb. Saflık kriteri, erime noktası, kaynama noktası, yoğunluk, çözünürlük, kristal form, kırılma indisi vb. gibi fiziksel sabitlerine göre değerlendirilebilir.
niteliksel analiz Bileşiği oluşturan elementlerin, özellikle Karbon, Hidrojen ve Azot ve bazen Halojenler, Kükürt ve Fosforun varlığı araştırılarak doğrulanır.
nicel analiz Nitel analiz için kullanılan yöntemler temel alınarak gerçekleştirilir. Başlangıç noktası, yanmaya maruz kalan belirli bir miktar maddedir ve karbondioksit toplanır ve tartılır. Karbon ve Hidrojen yüzdesini hesaplamak için oluşan karbon ve su buharı bileşik. Kantitatif analizin sonuçları, hesaplamayı kolaylaştırır. ampirik formül, moleküler formül ancak maddenin moleküler ağırlığının belirlenmesinden sonra bulunabilir. Ancak problem henüz çözülmedi, çünkü aynı moleküler formül farklı izomerlere karşılık gelebilir.
Organik Bileşiklerin Sınıflandırılması
Organik bileşikler yapılarına göre bileşiklere ayrılır. alifatik, aromatik Y heterosiklik. Alifatik bileşikler metan CH ile ilgilidir4, sikloparafinler hariç açık zincirlidir ve isimlerini hayvansal ve bitkisel yağların bu gruba ait olmasına borçludur.
aromatik bileşikler, kapalı zincir, benzen, C ile yakından ilgili6H6ve isimlerini birçoğunun hoş kokulu, hoş kokulara sahip olmalarına borçludurlar.
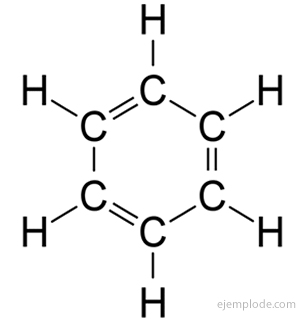
Benzen Yüzük
heterosiklik bileşikler Halkası karbon dışında bir element içeren kapalı zincirli bileşiklerdir.
Anayasalarına göre bunlar:
hidrokarbonlar, sahip olduğu bağlantıların türü nedeniyle şu şekilde sınıflandırılır: alkanlar, alkenler Y alkinler. Ayrıca Sikloalkanlar, Benzen ve bunların sadece Karbon ve Hidrojenden oluşan türevleri de bu kategoridedir.
heterosiklik bileşikler
Halojenli türevler:R-X
Nitro bileşikleri:R-HAYIR2
Sülfonik Asitler:R-SO3H
Nitriller (OR alkil siyanürler) ve İzonitriller:R-CN ve R-NC. Azot atomunun molekülde nasıl bağlandığı konusunda farklılık gösterirler.
Alkoller:R-OH
Fenoller: Hidroksil grubu eklenmiş bir benzen halkasından oluşan bir omurgaya dayalı bileşikler.

Eterler:R-O-R
Merkaptanlar: R-SH
Tiyoeterler:R-S-R
Tiyoasitler:R-COSH
Aldehitler:R-CHO
ketonlar:R-CO-R
Karboksilik asitler:R-COOH
Dışarı çıkıyorsun:R-COOM (Metal için M)
Esterler: R-COO-R
Anhidritler: R-CO-O-OC-R
aminler:R-NH2, R-NH-R, 2R-N-R
Aldosa tipi karbonhidratlar:-CHOH-CHOH-CHO
Ketoz tipi karbonhidratlar:-CHOH-CO-CH2Ah
Organometalik bileşikler:R-M-R
Metal-Alkil Halidler:R-MX (ayrıca Grignard Reaktifleri olarak da bilinir)
