Kimyasal Bağ Türleri
Kimya / / July 04, 2021
İki veya daha fazla atom bir molekül oluşturduğunda, bir araya gelerek birleşirler. elektronlar arasındaki bağlantı son katmanlarından en yüzeysel olanı. Bu birliğin adı Kimyasal bağ. Kimyasal bir bağın oluşabilmesi için atomların kendi özelliklerine sahip olmaları gerekir. tamamlanmamış sekizli, yani son kabuklarında sekizden az elektron vardır, bu onlara kimyasal kararlılık verecek sayıdır.
Üç tür kimyasal bağ vardır:
- İyonik bağlar
- Kovalent bağlar
- Metal bağlantılar
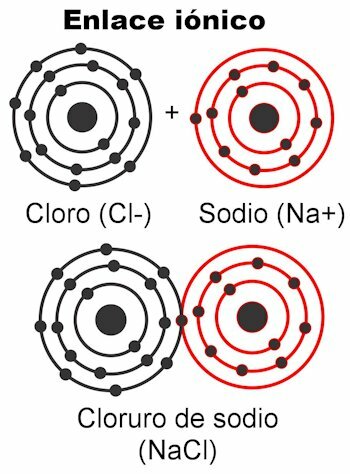
İyonik bağlar
İyonik bağlar, değerlik elektronlarının elektrostatik kuvvetler tarafından çekilir. 1 ila 4 değerlik elektronuna sahip atom(lar) onları bağ oluşturmak üzere iletebilir; Bu ona pozitif bir yük verir, çünkü negatif yüklerden kurtulacaktır. Öte yandan, 5 ila 7 değerlik elektronlu atom(lar) 8'e ulaşmak için gerekli olanları alabilecektir.
Bu onlara negatif bir yük verir, çünkü negatif olan elektronları alırlar. Elektronların yakalanabilmesi veya iletilebilmesi gerçeği atomlara elektrik yükünü verir. Coulomb yasasına göre her iki atomda oluşan yükler
bir kuvvetle birbirlerini çekecekler, yukarıda belirtilen elektrostatik olan. Negatif yükler pozitif yükler çeker ve bunun tersi de geçerlidir. Zıt yükler çeker. Bu kuvvet onları birbirine bağladığında molekül oluşur.İyonik bağlar çoğunlukla oluşur metal ve ametal atomları arasında. Metaller elektronlarından vazgeçerler ve her zaman pozitif bir yük taşırlar, katyon (+) olarak katılırlar. Ametaller elektron alıcılarıdır ve genellikle negatif yük taşırlar. anyonlar (-) ama aynı zamanda pozitif bir yük taşıdıkları da olur, bu, yüklü atom grupları oluşturduklarında aranan radikaller, amonyum NH olarak4+, karbonat CO3-2, fosfat PO4-3.
İyonik bağların oluşturduğu kimyasal bileşikler arasında şunlar bulunur:
- ikili tuzlar
- Oksisaller
Bu maddeler suda çözündüğünde ayrışırlar, yani, elektrik yüklerine ayırmak ve bunlar hidrojen iyonları H ile birlikte suda dağılır.+ ve hidroksil (OH-) su oluşturur. Oluşan karışıma çözelti adı verilir. elektrolit.
- Okumaya devam et: İyonik bağ
Kovalent bağlar
Kovalent bağlar, elektronların paylaşıldığı bağlardır. onları atomdan ayırmadan, yani, elektrik yüklerinin oluşumu olmadan. Atomlar yakınlık ile bir arada tutulur ve çekirdeğin elektronları çekmesi için gereken kuvveti kullanır. Bağ bir kez oluştuktan sonra, atomların iki veya daha fazla çekirdeği, paylaşılan elektronları çekerek, oktet kuralını yerine getirir ve molekülü kararlı hale getirir.
Birkaç kovalent bağ şekli vardır ve bunlar:
- Kovalent bağ
- Koordinat kovalent bağ
- polar kovalent bağ
- polar olmayan kovalent bağ
kovalent bağ Tıpkı başta anlatılan gibi. Katılan atomlar elektronları paylaşır, böylece hepsinin tam sekizlisi olur. Burada elektrik yükü yoktur, çünkü elektronlar dökülmez, sadece paylaşılırlar.
İçinde koordine kovalent bağ bağ için gerekli tüm elektronlara katkıda bulunan tek bir atomdur. Diğer atom basitçe birbirine bağlanır ve bu elektronları kendisininmiş gibi alır. Molekül böyle oluşur. Bu, örneğin, sülfürik asit H'nin durumudur.2GB4 burada kükürt oksijen atomlarıyla iki çift elektronu paylaşır.
İçinde polar kovalent bağ, atomlar arasındaki kuvvetler molekülün bir tarafına eğilir. Bu farklı atom türleri olduğunda molekülde. Bu kuvvet Debye birimlerinde ölçülür ve molekülün bir tarafındaki değeri ne kadar yüksek olursa, o kadar polar olur. Bu, yapıda kutupların oluştuğu anlamına gelir ve bu nedenle bu isim verilir. Kuvvetleri asimetriktir.
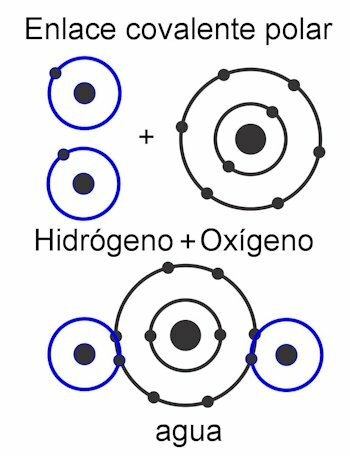
İçinde polar olmayan kovalent bağatomlar arasındaki kuvvetler tüm molekül boyunca eşittir ve bu nedenle yapısında kutup oluşmaz. Tek bir birim olarak çalışır ve bu nedenle yüklerini bölmek çok zor, neredeyse imkansızdır. Bu onu suda çözünmez hale getirir. Bu, aşağıdaki gibi bileşiklerin durumudur: alkanlarMolekül boyunca eşit kuvvetleri olan. Kuvvetleri simetriktir.

- Okumaya devam et: Kovalent bağ
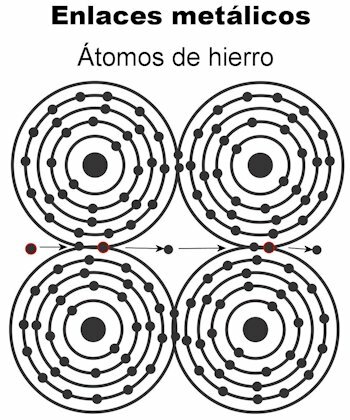
metalik bağ
Bir metalin atomları metalik bağlar vasıtasıyla bir arada tutulur. Bu tür bir bağda, tüm atomların elektronları, sağlam kalan kristal bir kafes oluşturmak için çekilir. Kristal kafesin bağları, tüm elektronları serpiştirmiştir ve elektrik akımı ve ısı taşımak için düzenlenmiş kendilerine iletildiğinde. Geçiş metallerinde bu metalik bağ yapısı daha dikkat çekicidir çünkü atomları daha büyüktür.
iyonik bağ örnekleri
İyonik bağa sahip bazı maddeler şunlardır:
- NaCl sodyum klorür. İyonları Na+ ve Cl-.
- Potasyum klorür KCl. İyonları K+ ve Cl-.
- Kalsiyum klorür CaCl2. İyonları Ca+2 ve Cl-.
- Magnezyum klorür MgCl2. İyonları Mg+2 ve Cl-.
- Stronsiyum Klorür SrCl2. İyonları Sr+2 ve Cl-.
- Baryum Klorür BaCl2. İyonları Ba'dır.+2 ve Cl-.
- Alüminyum Klorür AlCl3. Onun iyonları Al+3 ve Cl-.
- Na sodyum sülfat2GB4. İyonları Na+ Ve bu yüzden4-2.
- Potasyum K sülfat2GB4. İyonları K+ Ve bu yüzden4-2.
- Kalsiyum sülfat CaSO4. İyonları Ca+2 Ve bu yüzden4-2.
- Kalsiyum sülfat MgSO4. İyonları Mg+2 Ve bu yüzden4-2.
- Stronsiyum Sülfat SrSO4. İyonları Sr+2 Ve bu yüzden4-2.
- Baryum Sülfat BaSO4. İyonları Ba'dır.+2 Ve bu yüzden4-2.
- Na sodyum fosfat3PO4. İyonları Na+ ve PO4-3.
- Potasyum K fosfat3PO4. İyonları K+ ve PO4-3.
- Magnezyum Fosfat Mg3(PO4)2. İyonları Mg+2 ve PO4-3.
- Kalsiyum fosfat Ca3(PO4)2. İyonları Ca+2 ve PO4-3.
- Alüminyum Fosfat AlPO4. Onun iyonları Al+3 ve PO4-3.
- Demirli Fosfat Fe3(PO4)2. İyonları Fe+2 ve PO4-3.
- Demir Fosfat FePO4. İyonları Fe+3 ve PO4-3.
kovalent bağ örnekleri
Kovalent bağ gösteren bazı maddeler şunlardır:
- metan CH4.
- etan C2H6.
- propan C3H8.
- Bütan C4H10.
- Pentan C5H12.
- heksan C6H14.
- heptan C7H16.
- oktan C8H18.
- propilen CH2= CH2–CH3.
- asetilen C2H2.
- Metil alkol CH3
- Etil alkol C2H5
- Propil alkol C3H7
- izopropil alkol CH3CH (OH) CH3.
- 2-propanon veya aseton CH3araba3.
- Formaldehit HCHO.
- asetaldehit CH3
- propionaldehit CH3CH2
- bütiraldehit CH3CH2CH2
- Formik asit HCOOH.
Metalik bağ örnekleri
Metalik bağ oluşturan bazı maddeler şunlardır:
- çinko çinko
- Kadmiyum Cd
- Bakır Cu
- Gümüş Ag
- Altın Au
- Nikel Ni
- Paladyum Pd
- platin Pt
- Kobalt Şirketi
- Rodyum Rodyum
- iridyum git
- Demir Fe
- Rutenyum Ru
- Osmiyum Os
- Manganez Mn
- krom krom
- Molibden Mo
- Wolfram K
- Vanadyum V
- Zrkonyum Zr
Şununla takip edin:
- atomlar
- İyon
- metaller
- Metal yok
- alkanlar
- Çözümler


