Визначення фазової діаграми
Різне / / December 22, 2021
Концептуальне визначення
Фазова діаграма являє собою наочне зображення залежності від температури і тиску чистої речовини в закритій системі. Поясніть зміни агрегатних станів речовини в залежності від тиску і температури, яким піддається речовина.

Інженер-хімік
Попередньо доцільно зрозуміти, що ми маємо на увазі під змінами агрегатного стану. Це, зокрема, зміни стану або фази. Коли речовина проста, наприклад, молекулярні рідини, вона має чітко визначені температури плавлення та кипіння. Тоді як при збільшенні молярної маси ці температури стають діапазонами, точніше, інтервалами, між якими відбувається зміна фаз.
Навіть у багатьох випадках певні температури зміни фаз не досягаються, оскільки речовини попередньо розкладаються. Визначаємо наступні фазові зміни, які будуть розташовані на діаграмах:
- Випаровування: з рідини в газ.
- Конденсація: з газу в рідину.
- Сублімація: від твердого до газоподібного.
- Зворотна сублімація: від газу до твердого.
- Затвердіння: від рідкого до твердого.
- Плавлення: від твердого до рідкого.
Загалом це теплові процеси, вони вимагають поглинання або доставка Енергія щоб вони відбувалися, так що, у міру додавання або видалення енергії, ми будемо рухатися вздовж діаграма фазі, щоб побачити, в якому агрегатному стані буде речовина.
Як ми добре знаємо, кожна речовина унікальна, тому кожна речовина матиме свою унікальну фазову діаграму. Тому на кожній діаграмі буде представлена потрійна точка, де тиск і температура в якому співіснують три фази (тверда, рідка і газоподібна). Баланс. Аналогічно представлена точка критичнийУ верхньому кінці кривої пари або газу ця точка вказує на те, що при більш високих температурах його неможливо привести до рідкого стану, якщо продовжувати збільшувати тиск газу.
Загалом фазові діаграми представлені таким чином:
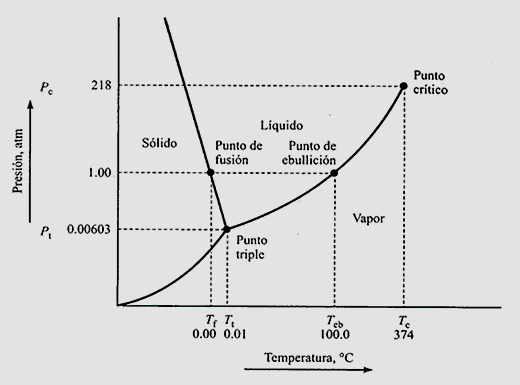
Тут спостерігається, а схема де тиск розташований на осі ординат, а температура — на осі абсцис. Загалом, області також можна розфарбувати для кращої візуалізації. Ліворуч від графічний речовина перебуває в твердому стані і при підвищенні температури (тобто збільшує енергію, що подається в систему) спостерігається перехід фази в рідину, а потім з рідини в пара. Поки ми рухаємося вище потрійної точки. Нижче потрійної точки зміна фази відбувається безпосередньо з твердої речовини в пар або навпаки, залежно від доставки або видалення енергії.
Кожна з представлених кривих є кривими рівноваги. Наприклад, крива від потрійної точки до критичної точки є кривою рівноваги рідини - пара, а крива ліворуч є кривою рівноваги рідина-тверде тіло. Нижче наведена рівновага тверда пара, оскільки при низьких температурах і тисках представлений тиск пари твердої речовини. Кожна з цих кривих рівноваги представляє фазові зміни, які були названі вище.
Представлена фазова діаграма, зокрема, є фазовою діаграмою води, відзначаючи, що при тиску 1 атм. температура кипіння 100ºC (нормальна температура кипіння), а температура плавлення 0ºC (температура плавлення нормальний). Критична точка спостерігається при критичній температурі 374ºC і критичному тиску 218 атм, тоді як потрійна точка, де співіснують три рівноваги, становить 0,00603 атм і 0,01ºC.
Крім того, ми можемо спостерігати, що, якщо ми збільшуємо тиск, температура плавлення зменшується температура кипіння підвищується, це пов'язано з нахилами кожної з кривих Баланс.
Як ми згадували раніше, кожна речовина має свою фазову діаграму, отже, тенденцію згадане не може бути відтворено у всіх тематичних дослідженнях, оскільки нахили кривих баланс змінюється.
Теми на фазовій діаграмі
