50 прикладів альдегідів і кетонів
Приклади / / November 06, 2023
The альдегіди є органічні сполуки які мають у своїй структурі карбонільну функціональну групу (= C = O), яка пов’язана з вуглецевим ланцюгом і атомом водню. Наприклад: метаналь (також званий формальдегідом), етаналь (також званий ацетальдегідом) і пропаналь (також званий пропальдегідом).
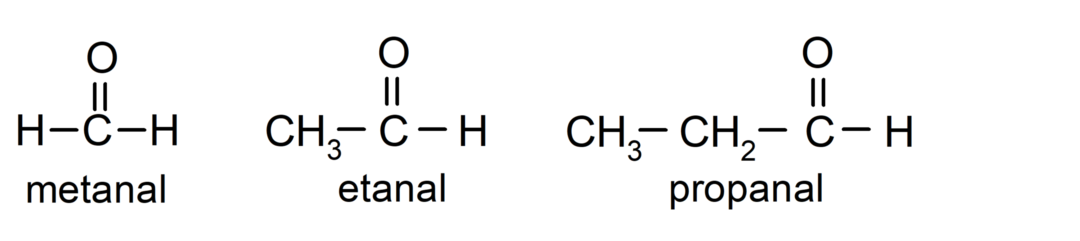
The кетони Це органічні сполуки, які мають у своїй структурі карбонільну групу, пов’язану з двома атомами вуглецю. Наприклад: пропанон (також званий ацетоном), бутанон і 2-пентанон.
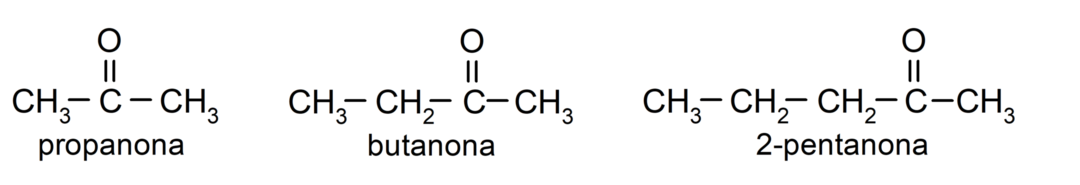
Відмінності між альдегідами та кетонами
Основні відмінності між альдегідами та кетонами:
- Альдегіди мають у своїй структурі карбонільну функціональну групу, розташовану на одному кінцевому кінці, тоді як кетони мають карбонільну групу, розташовану в некінцевих положеннях структура.
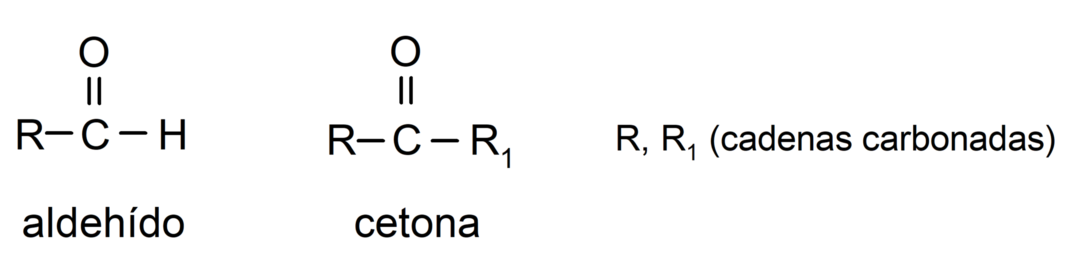
- Альдегіди окислюються реакцією з реактивом Толленса, утворюючи металеве срібло. Вони також окислюються проти реактиву Бенедикта, утворюючи оксид міді. Кетони не окислюються жодним реагентом.
- Альдегіди відновлюються до первинних спиртів, тоді як кетони відновлюються до вторинних спиртів.
Фізичні властивості
Фізичні властивості альдегідів
Фізичні властивості альдегідів дуже різноманітні, оскільки вони залежать від будови вуглецевого ланцюга, з’єднаного з карбонільною групою.
Деякі з них:
- Найбільш розчинні у воді альдегіди меншого розміру, наприклад метаналь і етаналь.
- Летючі альдегіди мають різкий і навіть дратівливий запах.
- Карбонільна група надає їм полярність.
- Зазвичай вони мають вищі точки кипіння, ніж хімічні сполуки подібного молекулярного розміру.
Фізичні властивості кетонів
Фізичні властивості кетонів залежать від того, як утворений вуглецевий ланцюг, пов’язаний з карбонільною групою.
- Багато кетонів мають приємний запах.
- Його розчинність у воді залежить від розміру вуглецевого ланцюга, приєднаного до карбонільної групи. Чим менший вуглецевий ланцюг, тим більше розчинний кетон у воді.
- Карбонільна група надає їм помітну полярність.
- Вони мають досить високі температури кипіння порівняно з хімічними сполуками порівнянного молекулярного розміру.
Хімічні властивості
Хімічні властивості альдегідів
Серед хімічних властивостей альдегідів можна знайти:
Вони окислюються з утворенням відповідної карбонової кислоти, тобто утворена кислота матиме таку саму кількість атомів вуглецю в карбоновому ланцюзі, що й кислота альдегід що породило його. Наприклад:
- Окислення реактивом Толленса (аміачний комплекс срібла в основному розчині, [Ag (NH3)2]+) з етаналю виробляє етанову кислоту і металеве срібло.
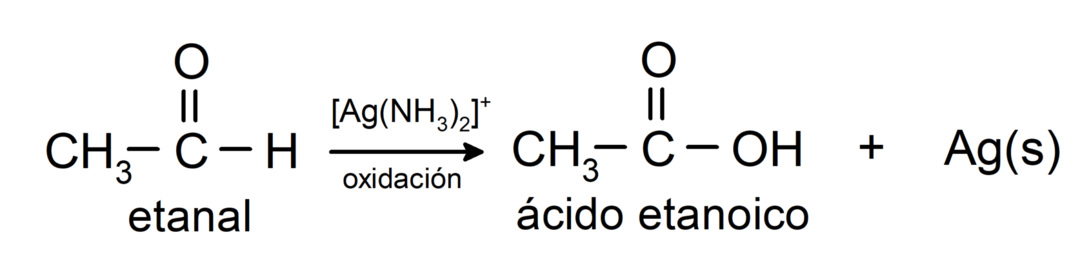
- При окисленні реактивом Бенедикта (лужним розчином мідного купоросу) етаналю утворюються етанова кислота і оксид міді.
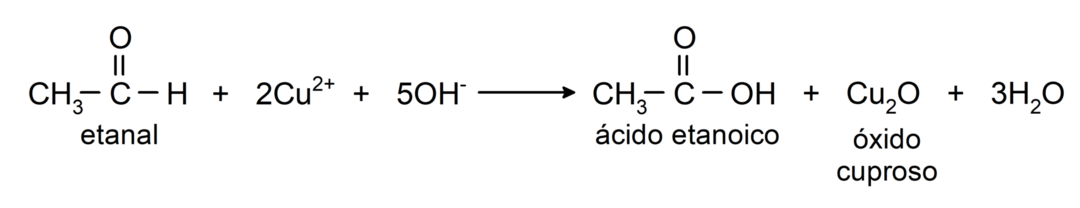
Вони вступають у реакції нуклеофільного приєднання, тобто приєднання нуклеофілу до карбонільної групи. Наприклад:
- Приєднання синильної кислоти з утворенням ціаногідринів або ціаногідринів.
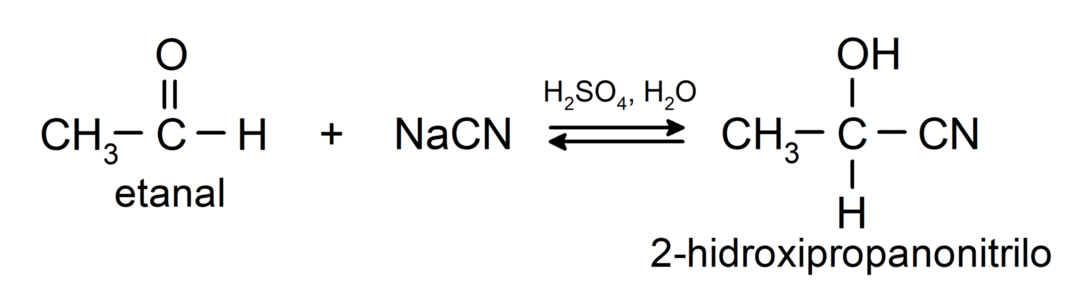
- У присутності безводних кислот до карбонільної групи альдегідів приєднуються спирти, утворюючи ацеталі та напівацеталі.
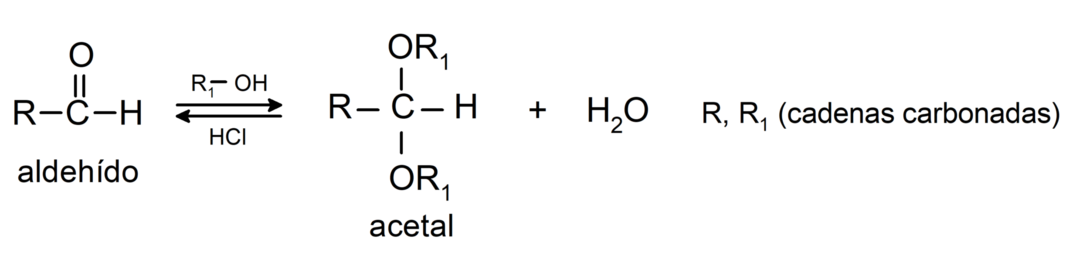
У них відбуваються реакції альдольної конденсації. У цих реакціях з’єднання двох альдегідів відбувається в присутності гідроксиду натрію (NaOH) і хімічна сполука отримане в результаті називається альдолом. Наприклад:
- Реакція конденсації етаналю в присутності розведеного NaOH.
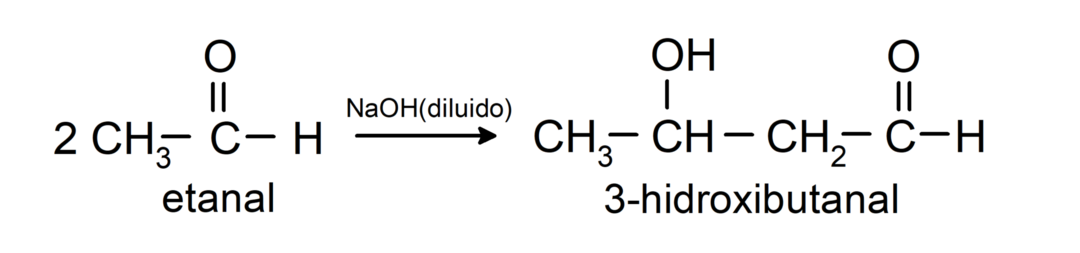
Вони відновлюються до первинних спиртів. Альдегіди можна відновити до первинних спиртів каталітичним гідруванням або відновленням борогідридом натрію (NaBH).4) і алюмогідрид літію (LiAlH4).
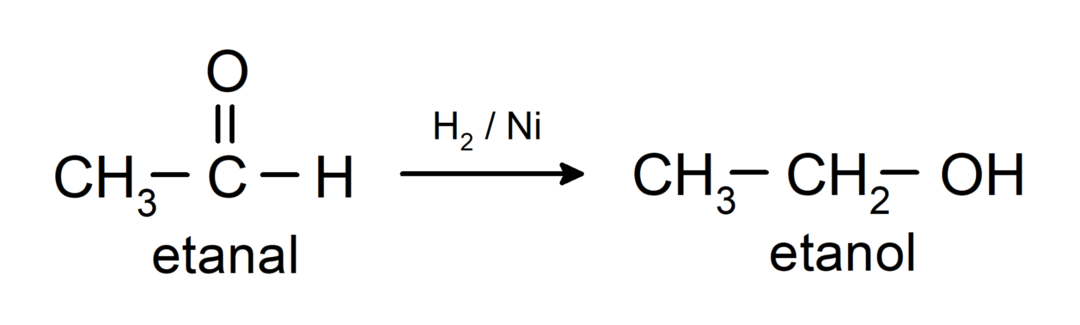
Хімічні властивості кетонів
Серед хімічних властивостей кетонів можна знайти:
Вони вступають у реакції нуклеофільного приєднання. Наприклад:
- Приєднання синильної кислоти з утворенням ціаногідринів або ціаногідринів.
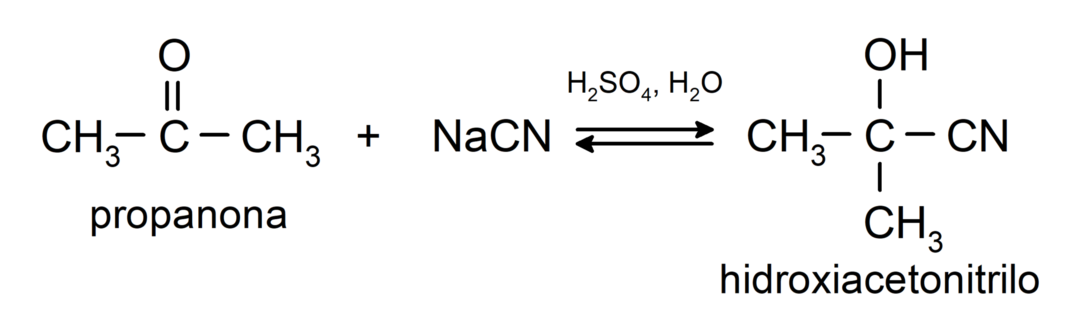
У них додають спирти (у присутності безводних кислот) до карбонільної групи кетонів з утворенням кеталів і напівкеталів. Наприклад:
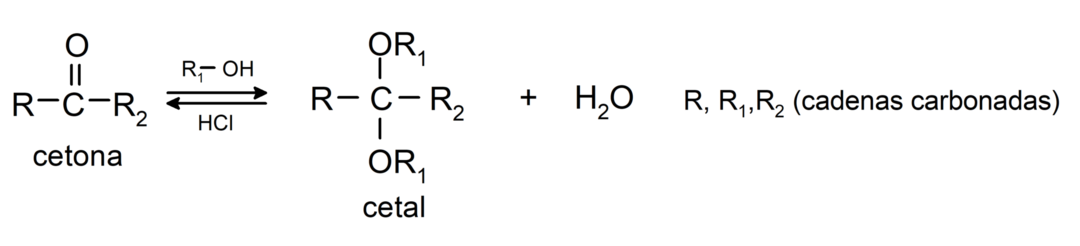
Вони вступають у реакції галогенування. Кетони, які мають альфа-водень (α) реагують шляхом заміни цього водню на галогени (хлор (Cl), бром (Br), йод (I), фтор (F)) у присутності кислотних або основних каталізаторів. Заміщення відбувається майже виключно у вуглеці α, тобто вуглець, який з’єднався з воднем α. Наприклад:
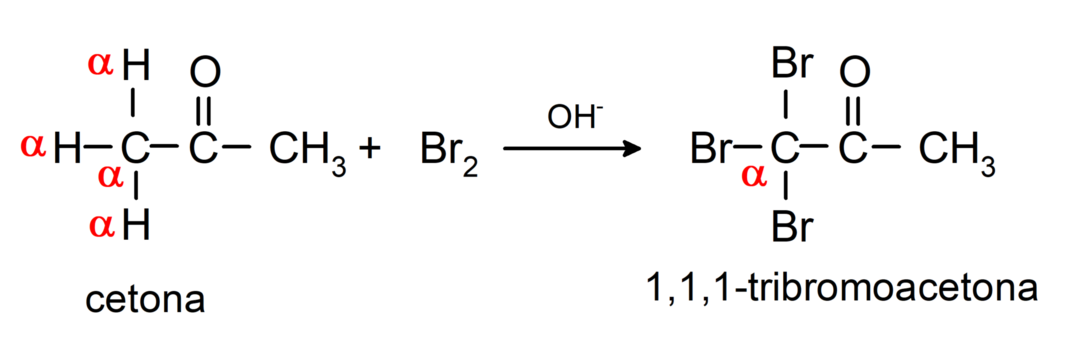
Вони відновлюються до вторинних спиртів каталітичним гідруванням або відновленням борогідридом натрію (NaBH4) і алюмогідрид літію (LiAlH4). Наприклад:
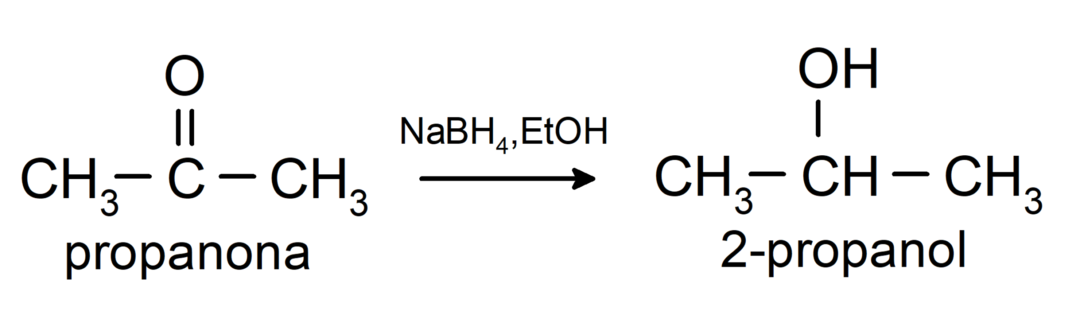
Кетони не окислюються реактивами Толленса і Бенедикта.
Номенклатура альдегідів
Відповідно до правил, встановлених Міжнародним союзом теоретичної та прикладної хімії (IUPAC), Альдегіди називаються за допомогою префіксів, які вказують на кількість атомів вуглецю в ланцюзі. газовані. Немає необхідності вказувати положення карбонільної групи, оскільки вона завжди знаходиться в положенні один, на одному кінці молекули. Крім того, суфікс -al пишеться в кінці назви альдегіду. Наприклад:
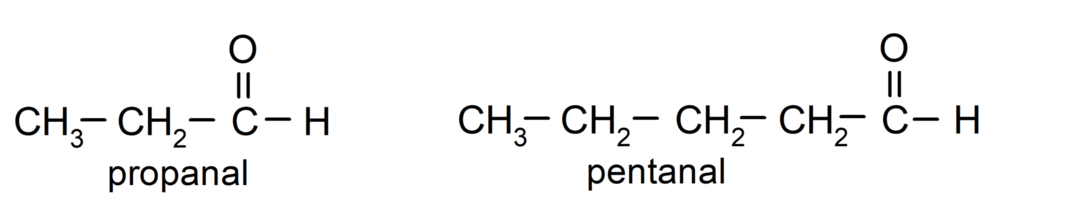
Якщо альдегід складається з кількох вуглецевих ланцюгів, тобто має розгалуження, то головним вибирають вуглецевий ланцюг з найбільшою кількістю атомів вуглецю. Інші ланцюги називають групами замісників, а положення кожного замісника вибирають таким чином, щоб він займав найменше можливе число в ланцюзі. Крім того, атоми вуглецю починають підраховувати, починаючи з кінця, який має карбонільну групу. Наприклад:
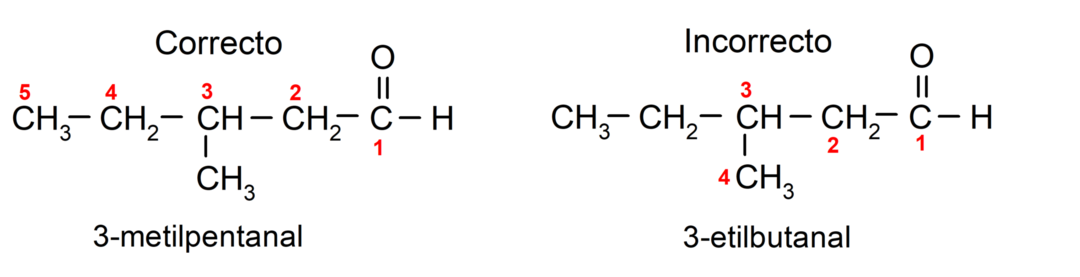
Альдегіди, які мають дві карбонільні групи, називаються за допомогою суфікса -dial. Наприклад:
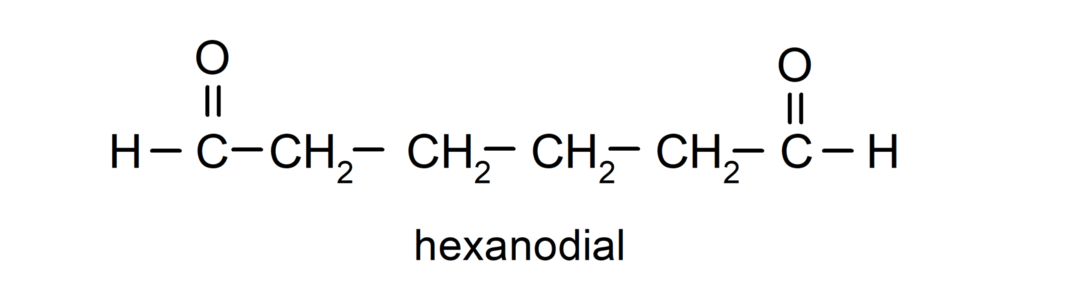
Номенклатура кетонів
Відповідно до Міжнародного союзу теоретичної та прикладної хімії (IUPAC), кетони називаються за допомогою префіксів, які вказують на кількість атомів вуглецю в вуглецевому ланцюзі.
З іншого боку, назва ацетону пишеться за допомогою суфікса -one, перед яким стоїть число, яке вказує на положення карбонільної групи в вуглецевому ланцюзі. Розташування карбонільної групи має бути вибрано таким чином, щоб воно відповідало найменшій можливій нумерації. Наприклад:
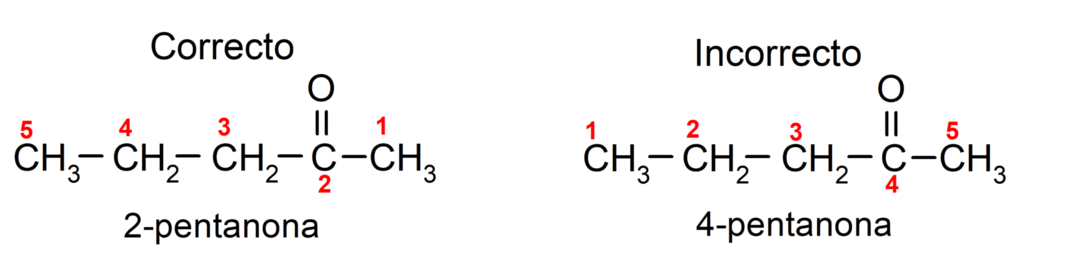
Щоб назвати кетон, який складається з кількох вуглецевих ланцюгів, тобто з розгалуженнями, вибираємо як головний ланцюг, вуглецевий ланцюг з найбільшою кількістю атомів вуглецю, який містить групу карбоніл. Решта ланцюгів називаються групами замісників. Наприклад:
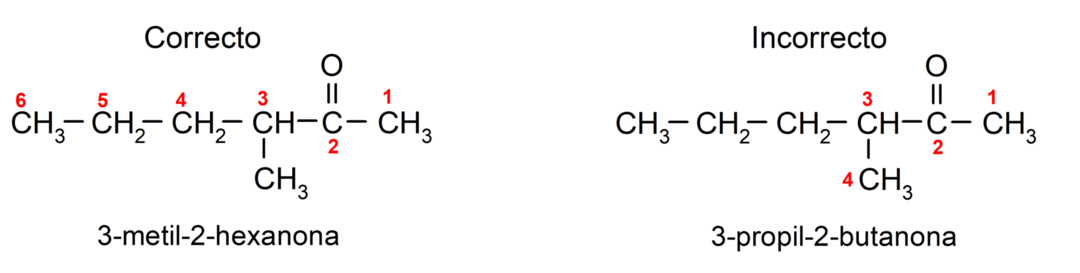
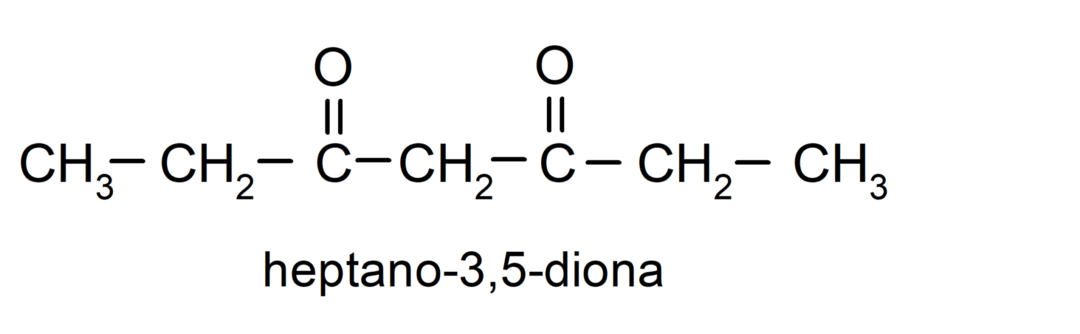
Існують кетони, які мають дві карбонільні групи, їх називають діонами. Наприклад:
Приклади альдегідів
- метанал (формальдегід)
- етаналь (ацетальдегід)
- пропанал (пропальдегід)
- бутаналь
- пентанал
- гексанал
- 3-бромциклопентанкарбальдегід
- циклогексанкарбальдегід
- бензальдегід
- 4,4-диметилпентанал
- 2-гідрокси-бутанал
- 2-гідрокси-2-метил-бутанал
- 2,3-диметилпентанал
- пентанедіальний
- 4-гідрокси-3-метоксибензальдегід
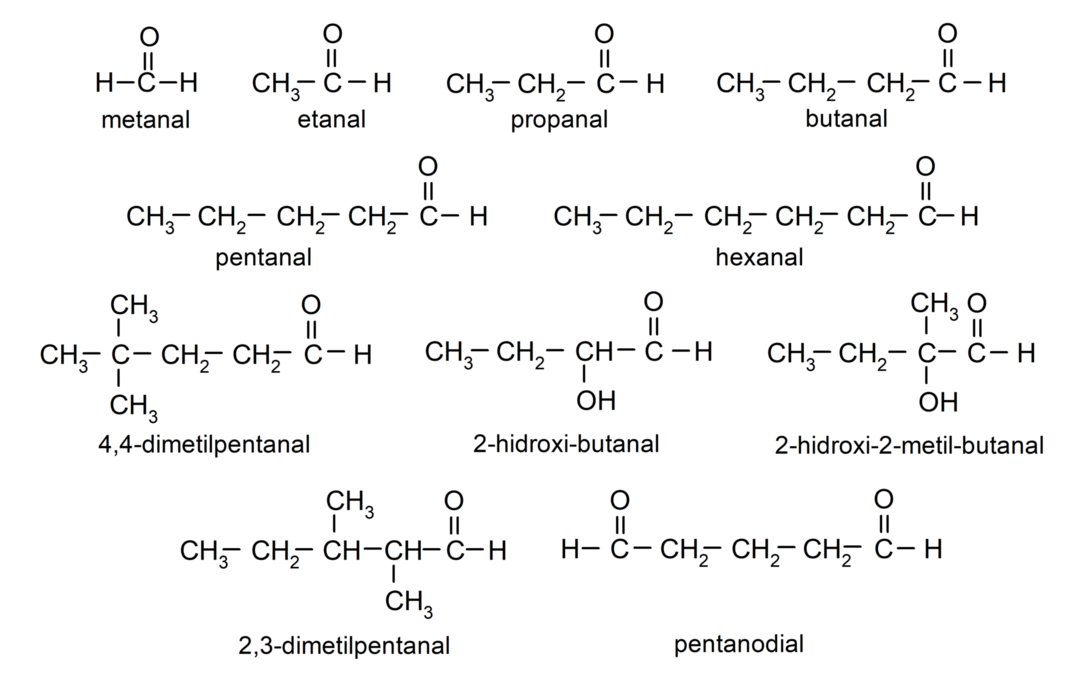
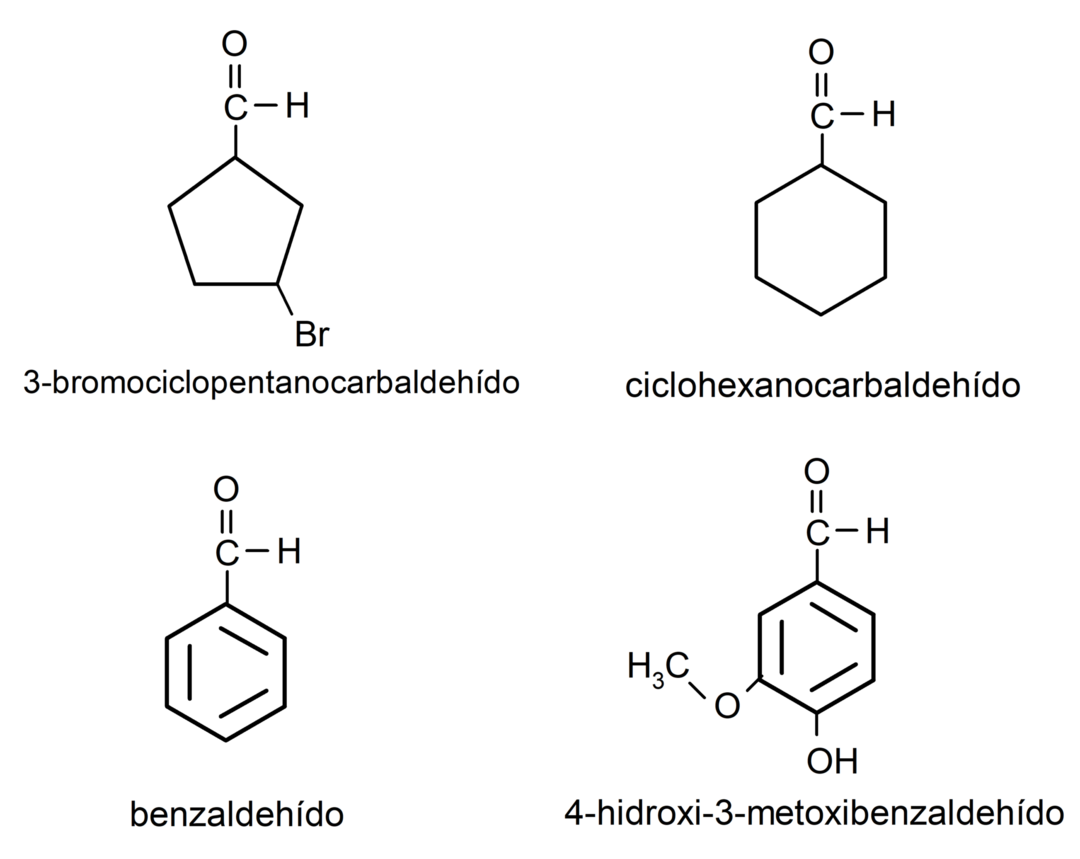
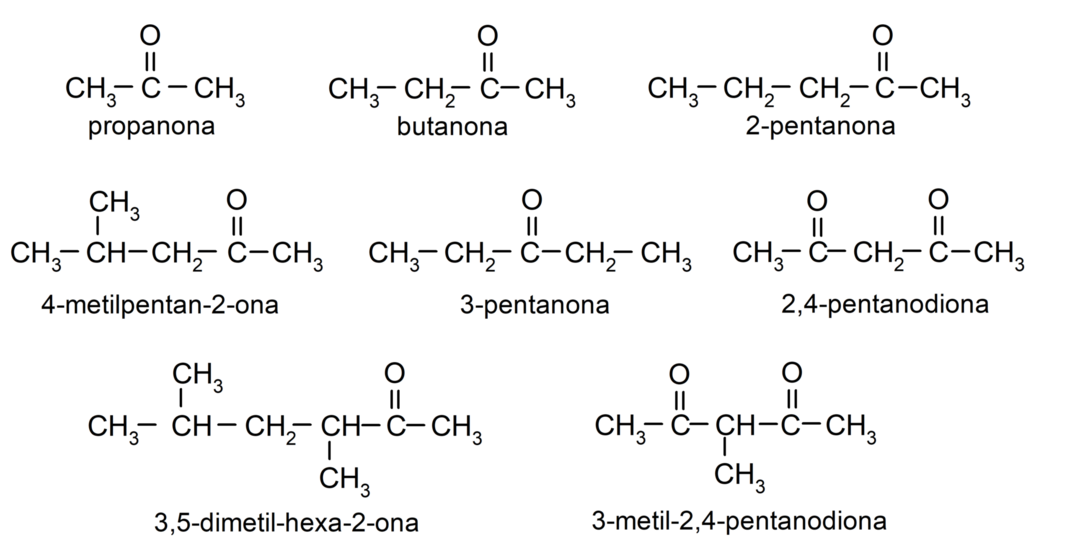
Приклади кетонів
- пропанон (ацетон)
- бутанон
- 2-пентанон
- 4-метилпентан-2-он
- 3-метилциклогексанон
- циклогексилметилкетон
- 3,4-диметил-гексан-2-он
- етилфенілкетон
- 2,4-пентадіон
- циклогексанон
- 3-пентанон
- 3-метил-2,4-пентандион
- 1-фенілпропанон
- циклопентанон
- дифенілкетон
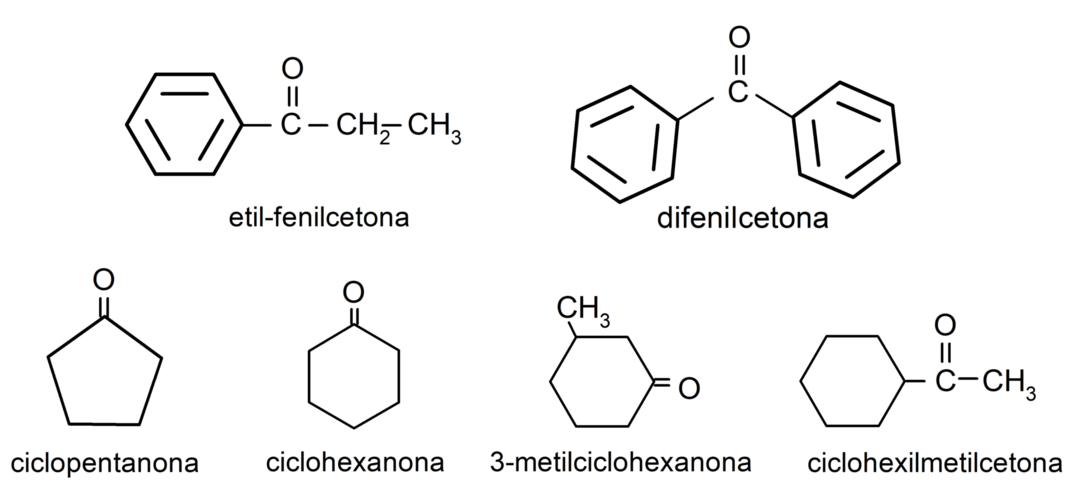
Використання альдегідів у побуті
Деякі види використання альдегідів:
- Вони використовуються для виробництва розчинників, фарб, парфумів, смол і есенцій.
- Вони використовуються як консерванти в косметичних продуктах, біологічних зразках і трупах. Для цих цілей найчастіше використовується формальдегід.
- Вони використовуються для виробництва пластмас, які дозволяють замінювати металеві деталі в автомобільній промисловості.
- Вони використовуються як ароматизатори для деяких харчових продуктів.
- Їх використовують як дезінфікуючі засоби.
- Їх використовували для виготовлення деяких вибухових речовин, таких як тетранітрат пентаеритриту (TNPE).
Використання кетонів у повсякденному житті
Деякі способи використання кетонів:
- Їх використовують у виробництві розчинників. Особливо ацетон широко використовується для видалення фарб і лаків.
- Вони використовуються у виробництві деяких гум і мастильних матеріалів.
- Їх використовують для виробництва фарб, лаків і лаків.
- Їх використовують для виробництва ліків і косметики.
Токсичність альдегідів і кетонів
- Альдегіди. Контакт з альдегідами викликає подразнення шкіри, очей і дихальних шляхів. Крім того, вплив альдегідів пов’язують із такими захворюваннями, як рак, контактний дерматит, захворювання печінки та нейродегенеративні захворювання. Формальдегід, наприклад, ВООЗ (Всесвітня організація охорони здоров'я) вважає канцерогенною сполукою.
- кетони. Повторний вплив кетонів може спричинити пошкодження центральної нервової системи. Це може призвести до втрати пам'яті, слабкості, м'язових болів і судом. Крім того, якщо шкіра контактує з кетонами, виникає сухість і тріщини. З іншого боку, при вдиханні кетонів виникає подразнення дихальних шляхів і кашель.
Список літератури
- Ллоренс Моліна, JA. (2018). “Альдегіди та кетони: кілька прикладів.” http://hdl.handle.net/
- Габріель Пінто Каньон, Мануела Мартін Санчес, Хосе Марія Ернандес Ернандес, Марія Тереза Мартін Санчес (2015) “Реактив Толленса: від ідентифікації альдегідів до їх використання в нанотехнологіях. Історичні аспекти та дидактичні застосування.”Том. 111 № 3. Королівське іспанське хімічне товариство.
- Вільям Бауер молодший (2000) «Метакрилова кислота та її похідні» в Encyclopedia of Industrial Chemistry Ульмана 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- «Вони розкривають новий механізм токсичності в групі канцерогенних сполук, які походять від дієти та навколишнього середовища» (2022) У: www.conicet.gov.ar Доступний у: https://www.conicet.gov.ar/ Доступ: 20 червня 2023 р.
Дотримуйтеся:
- Спирти
- цукри
- Алкани



