30 Приклади альдегідів
Приклади / / November 06, 2023
The альдегіди є органічні сполуки які утворені вуглецевим ланцюгом, до якого приєднана кінцева карбонільна група (= C = O) (розташована на одному кінці молекула), який, у свою чергу, зв’язаний з атомом водню.
Дуже поширеними альдегідами є метаналь (формальдегід), етаналь (ацетальдегід) і пропаналь (пропальдегід).

Деякі з цих сполук присутні в природі, наприклад, ванілін або ванілін є природним альдегідом, який є основним ароматизатором ванілі.
- Дивіться також: Альдегіди та кетони
Номенклатура альдегідів
Альдегіди можна називати за правилами номенклатури, встановленими Міжнародним союзом теоретичної та прикладної хімії (IUPAC).
Щоб назвати альдегід, використовуються префікси, які вказують на кількість атомів вуглецю, які вуглецевий ланцюг приєднав до карбонільної групи. Карбонільна група завжди розташована на одному кінці вуглецевого ланцюга, що означає, що вона завжди матиме позицію один і немає необхідності вказувати її розташування в ланцюзі. Крім того, суфікс -al ставиться в кінці назви альдегіду. Деякі приклади:
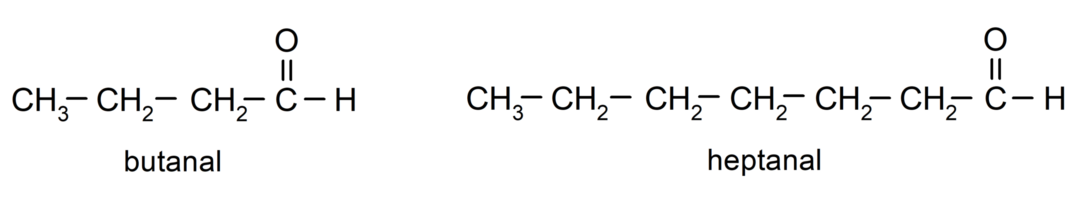
Якщо альдегід розгалужений, тобто він складається з кількох вуглецевих ланцюгів, то головний ланцюг як ланцюг, який містить найбільшу кількість атомів вуглецю, і який також містить групу карбоніл. Решта ланцюгів називаються групами замісників.
Крім того, кожна група заступників повинна бути обрана так, щоб її положення займало найменшу можливу нумерацію в головному вуглецевому ланцюзі. З іншого боку, атоми вуглецю головного ланцюга починають відраховуватися на кінці, який містить карбонільну групу. Деякі приклади:
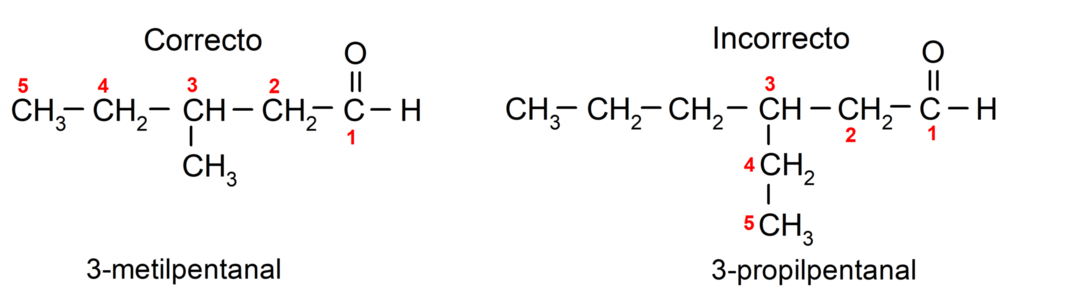
Якщо альдегід діє як замісник у молекулі, оскільки він також складається з груп більш пріоритетні функціональні групи, такі як кислоти та складні ефіри, тоді альдегідну групу називають -оксо. Наприклад:

Якщо альдегід має декілька карбонільних груп, його називають за допомогою префіксів, які вказують на кількість цих груп, циферблат (дві карбонільні групи), пробний (три карбонільні групи) тощо. Наприклад:
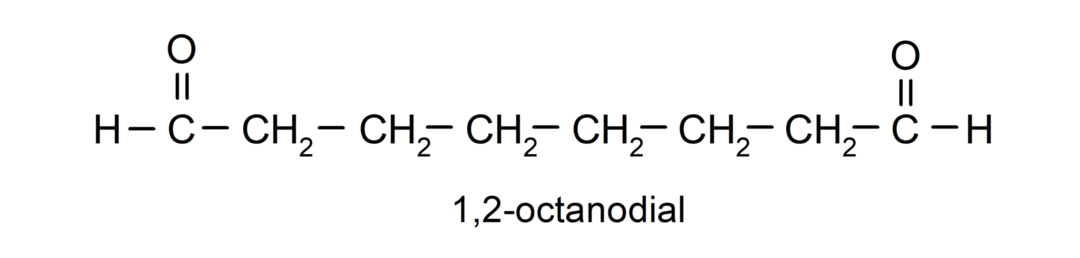
Коли карбонільна група пов’язана з циклом, альдегіди називаються терміном карбальдегід. Наприклад:

Фізичні властивості альдегідів
Альдегіди зазвичай мають деякі варіації тієї самої фізичної властивості. Це відбувається тому, що фізичні властивості альдегідів залежать від того, як утворюється вуглецевий ланцюг, приєднаний до карбонільної групи.
Деякі фізичні властивості альдегідів:
- Розчинність. Розчинність альдегідів у воді залежить від кількості атомів який має вуглецевий ланцюг. Альдегіди з коротшими вуглецевими ланцюгами (приблизно до п'яти атомів вуглецю) розчинні у воді. Альдегіди з вуглецевими ланцюгами з багатьох атомів вуглецю нерозчинні у воді. Метаналь і етаналь добре розчиняються у воді.
- Щільність. Загалом, альдегіди — це сполуки меншої щільності, ніж вода.
- Агрегаційні стани. Альдегіди складаються з одного і двох атомів Карбону гази, ті, що містять від трьох до дванадцяти атомів вуглецю рідини, а ті, що складаються з понад дванадцяти атомів вуглецю, є твердими.
- Запах. Деякі альдегіди мають подразливий запах, а інші – приємний.
- Полярність. Карбонільна група надає їм полярність.
- Точка кипіння. Вони мають вищі температури кипіння, ніж алкани з подібною молекулярною масою, і нижчі, ніж карбонові кислоти та спирти з порівнянною молекулярною масою.
Хімічні властивості альдегідів
Ось деякі з хімічних властивостей альдегідів:
Альдегіди окислюються при взаємодії з реактивами Толленса, Бенедикта і Фелінга. з утворенням відповідної карбонової кислоти. Утворена кислота матиме таку ж кількість атомів вуглецю в карбоновому ланцюзі, що й альдегід, з якого вона утворилася. Наприклад:
- Окислення реактивом Толленса (аміачний комплекс срібла в основному розчині, [Ag (NH3)2]+). Ця реакція дає відповідну кислоту та металеве срібло.

- Окислення реактивом Бенедикта і Фелінга (лужні розчини купрум (ІІ) сульфату (CuSO)4) з різними композиціями). Ця реакція дає відповідну кислоту та оксид міді (Cu2АБО).

Вони вступають у реакції нуклеофільного приєднання, де до карбонільної групи альдегідів приєднуються нуклеофіли. Деякі приклади:
- реакції приєднання спирти до карбонільної групи альдегідів з утворенням ацеталей і напівацеталей.
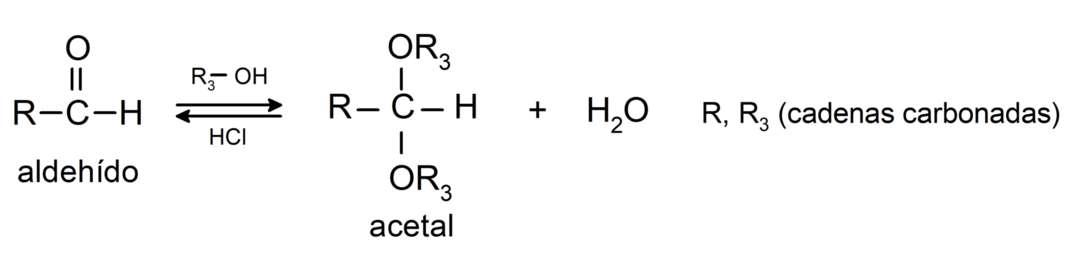
- реакції приєднання аміни первинний до карбонільної групи.

- Реакції приєднання синильної кислоти (HCN), де утворюються ціаногідрини або ціаногідрини.

У них відбуваються реакції альдольної конденсації. У цьому типі реакції два альдегіди конденсуються з утворенням альдолу. Це реакції, які відбуваються з гідроксидом натрію (NaOH). Наприклад:
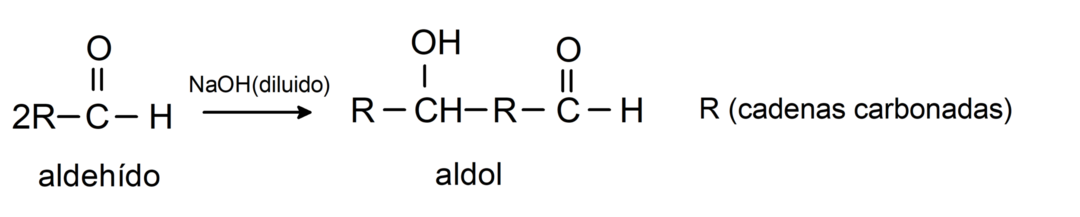
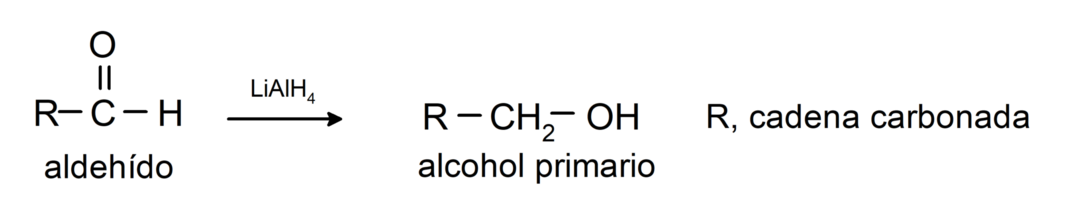
Вони піддаються реакціям відновлення до первинних спиртів. У присутності борогідриду натрію (NaBH4) і алюмогідриду літію (LiAlH4) або шляхом каталітичного гідрування вони відновлюються до первинних спиртів. Наприклад:
Приклади альдегідів
- метанал (формальдегід)
- етаналь (ацетальдегід)
- пропанал (пропальдегід)
- бутаналь
- пентанал
- ванілін
- коричний альдегід
- пропенал
- бензальдегід
- гексанал
- 3-бромциклопентанкарбальдегід
- циклогексанкарбальдегід
- 4,4-диметилпентанал
- 2-гідрокси-бутанал
- 2-гідрокси-2-метил-бутанал
- 2,3-диметилпентанал
- пентанедіальний
- циклопентанкарбальдегід
- ізобутанальний
- 2-хлор-бутанал

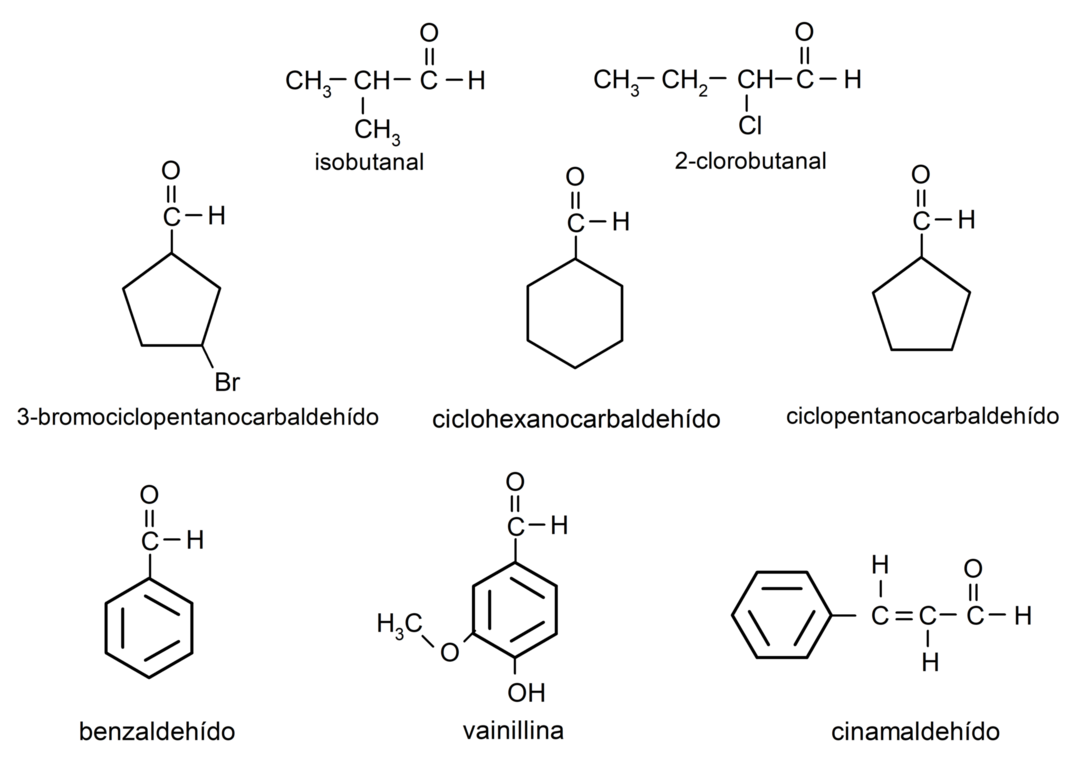
Альдегіди в природі
Деякі альдегіди, присутні в природі:
- Бензальдегід, компонент мигдалю.
- Коричний альдегід, компонент, який надає есенції кориці її запах.
- Ванілін, компонент, що надає ванілі смак.
З іншого боку, одна з форм глюкози, відкрита форма, має альдегідну функціональну групу.
Вважається, що ацетальдегід, який утворюється як проміжний продукт метаболізму алкоголю, викликає симптоми похмілля під час алкогольного сп’яніння.
Використання альдегідів
Деякі з основних застосувань альдегідів:
- Вони використовуються у виробництві розчинників, фарб, косметичних засобів і есенцій.
- Їх використовують у виробництві смол. Бакеліт виготовляється з формальдегіду і є смолою, яка дуже добре працює як електричний ізолятор.
- Їх використовували як заспокійливі засоби. Паральдегід використовувався як заспокійливий і снодійний засіб, хоча зараз він вийшов з ужитку через неприємний запах.
- Вони використовуються як консерванти для біологічних зразків і трупів. Формальдегід широко використовується в цьому сенсі.
- Їх використовують як харчові ароматизатори. Прикладом може служити ванілін, який використовується для додання десертам ванільного аромату.
- Їх використовують як дезінфікуючі засоби.
Шкода альдегідів
Кілька альдегідів вважаються канцерогенними, наприклад, формальдегід був оголошений канцерогенною сполукою згідно з ВООЗ (Всесвітня організація охорони здоров'я).
Вплив і контакт з багатьма альдегідами викликає подразнення шкіри, очей і дихальних шляхів. З іншого боку, це викликає контактний дерматит і захворювання печінки.
Список літератури
- Соломонс, Т.В. Грем і Марія Крістіна Сангінес Франкіні (1985). “органічна хіміяМексика, D.F.: Limusa.
- Віттен, К. В., Гейлі, К. Д., Девіс, Р. Е., де Сандовал, М. Т. ДО. О. та Мурадас Р. М. g. (1992). “Загальна хімія" (стор. 108-117). Макгроу-Хілл.
- Артеага, П. М. (2017). “Кетони і альдегіди” Науково-науковий вісник підготовчої школи №3, 4(8).
Дотримуйтеся:
- цукри
- Гідрациди
- Спирт етиловий
- Органічні та неорганічні сполуки



