30 прикладів алкоголю
Приклади / / November 06, 2023
The спирти є органічні хімічні сполуки які містять у своїй структурі гідроксильну функціональну групу (-ОН), приєднану до вуглецю (-С). Група (- C – OH) називається «карбінол». Деякі приклади алкоголю: метанол, етанол і 1-пропанол.
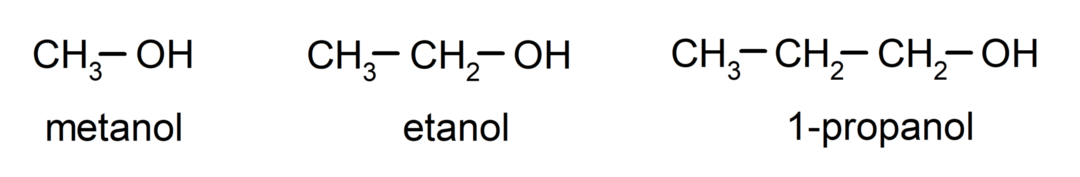
Спирти – це хімічні сполуки, які мають різноманітне застосування в побуті, оскільки вони мають антибактеріальні та антисептичні властивості. З іншого боку, вони можуть бути небезпечними для здоров'я людини при безконтрольному вживанні.
Так само не всі алкогольні напої можна вживати людиною.
- Дивіться також: Аміни та кетони
Види спиртів
Залежно від кількості атомів вуглецю, до яких приєднаний атом вуглецю, що має гідроксильну групу, спирт може бути:
- Первинний алкоголь. Атом вуглецю, до якого приєднана гідроксильна група, також приєднаний до одного атома вуглецю. Наприклад:
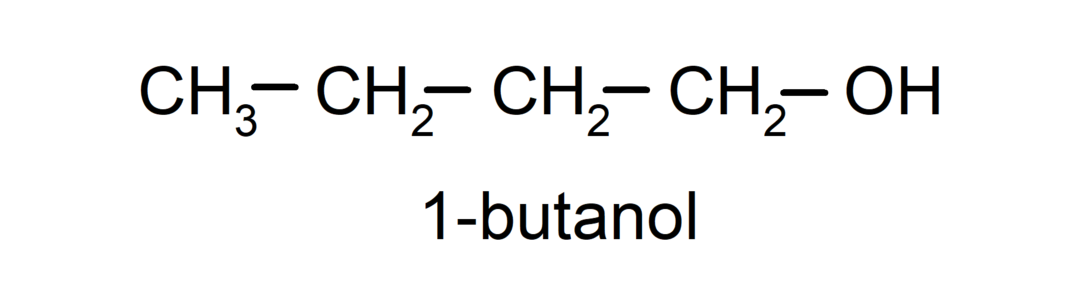
- Вторинний алкоголь. Атом вуглецю, до якого приєднана гідроксильна група, також пов’язаний з двома іншими атомами вуглецю. Наприклад:
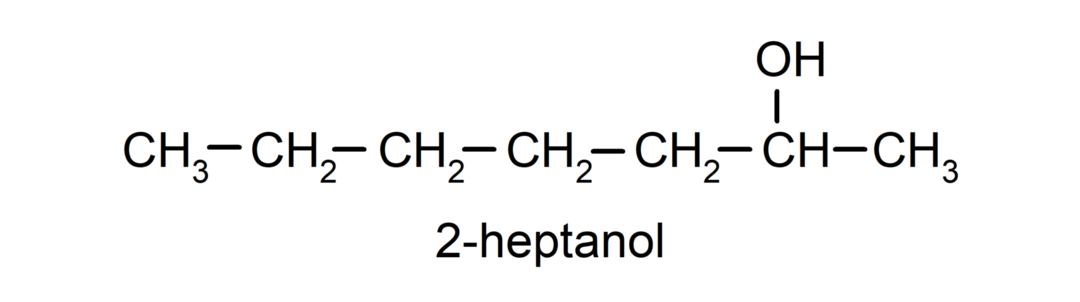
- Третинний спирт. Атом вуглецю, до якого приєднана гідроксильна група, також приєднаний до трьох атомів вуглецю. Наприклад:
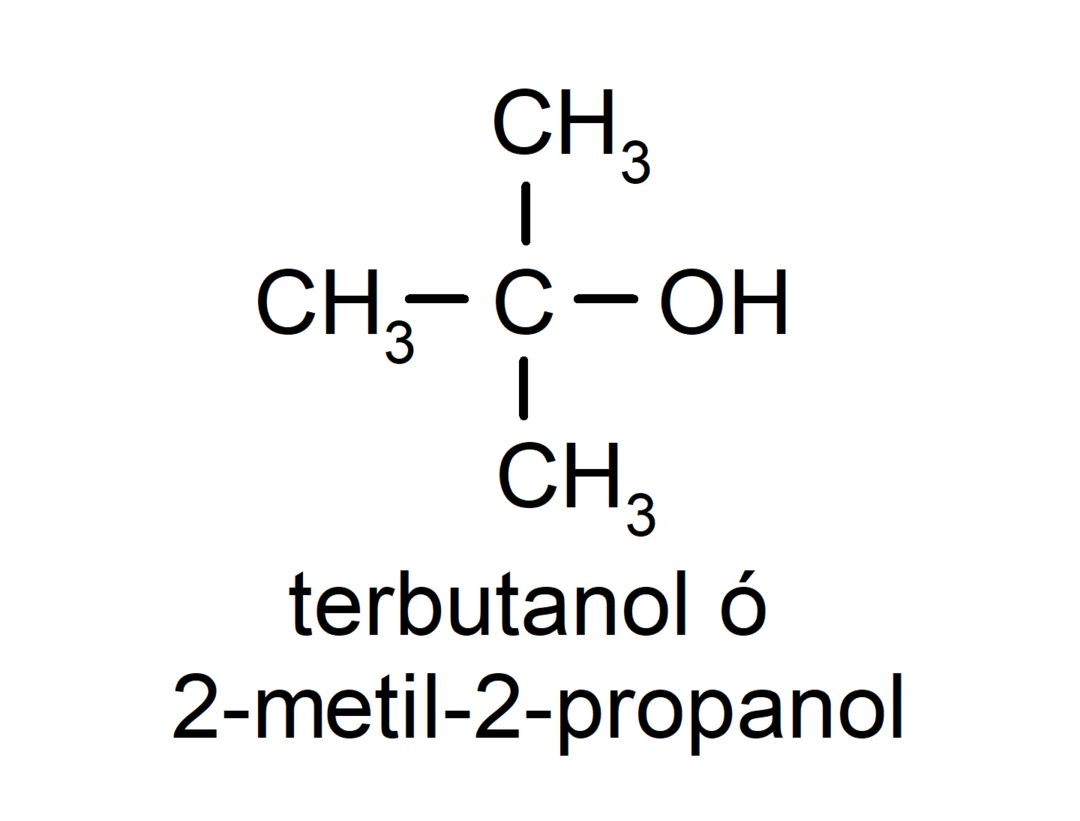
Залежно від кількості гідроксильних груп спирт буває:
- Діол. У своїй структурі він має дві гідроксильні групи. Наприклад:
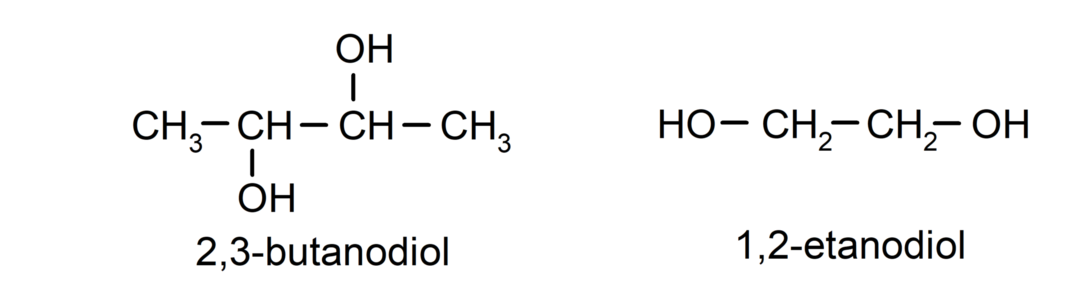
- Тріол. У своїй структурі він має три гідроксильні групи. Наприклад:
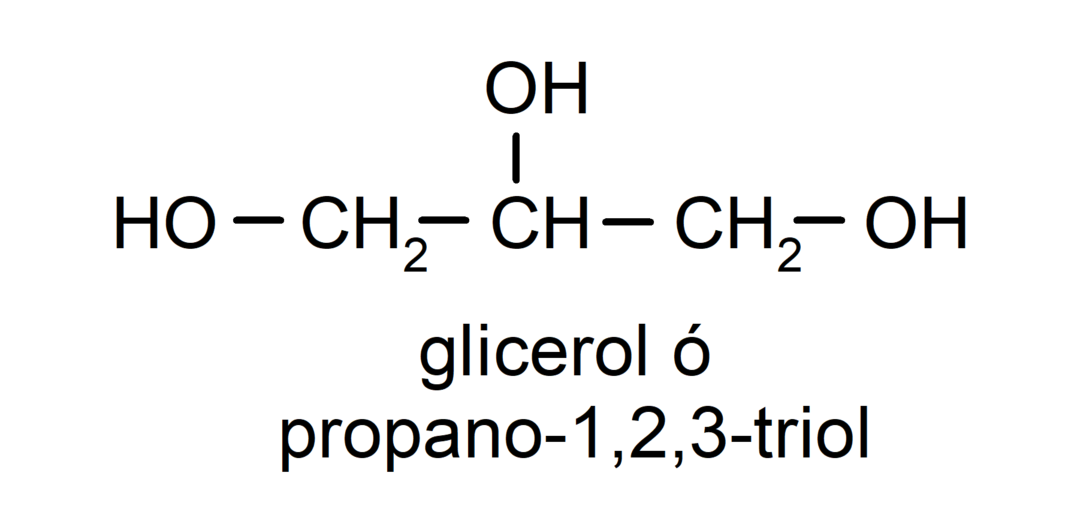
- Поліалкоголь. Він має багато гідроксильних груп у своїй структурі. Наприклад:
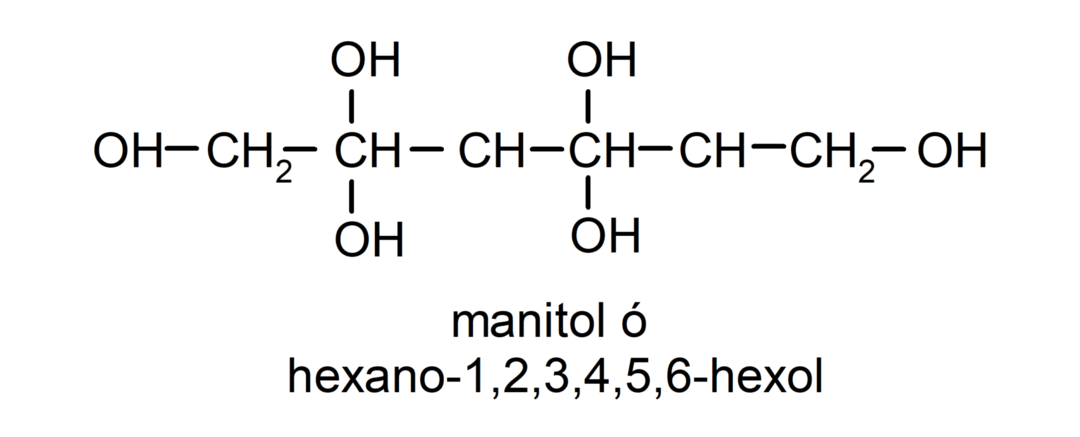
Фізичні властивості спиртів
Деякі з фізичних властивостей спиртів:
- Точка кипіння. Температура кипіння в спиртах досить висока через наявність гідроксильної групи, яка дозволяє утворювати водневі зв'язки. Крім того, чим більше гідроксильних функціональних груп присутнє в вуглецевому ланцюзі, тим вище Точка кипіння спиртів.
- Полярність. Спирти досить полярні сполуки.
- Розчинність. Низькомолекулярні спирти розчинні у воді. З іншого боку, чим більший вуглецевий ланцюг спиртів, тим менша їх розчинність у воді. Крім того, чим більше гідроксильних груп мають спирти, тим більша їх розчинність у воді.
- Агрегатний стан. Більшість спиртів є рідкими при кімнатній температурі (25ºC) і мають характерні запахи.
Хімічні властивості спиртів
Деякі хімічні властивості спиртів:
- Спирти поводяться як кислоти та основи.. Їх поведінку як кислот можна побачити в реакціях з активними металами з виділенням водню та утворенням алкоксидів.

Їх поведінку як основ можна побачити в таких реакціях, як реакція метанолу з бромистим воднем з утворенням броміду метилоксонію.
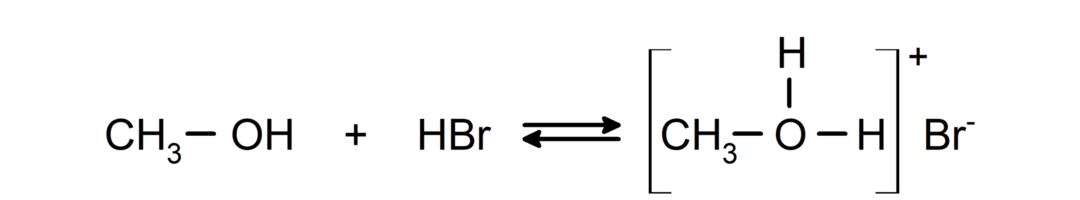
- Спирти вступають у реакції галогенування. Вони реагують з галогеноводнями з утворенням алкілгалогенідів.
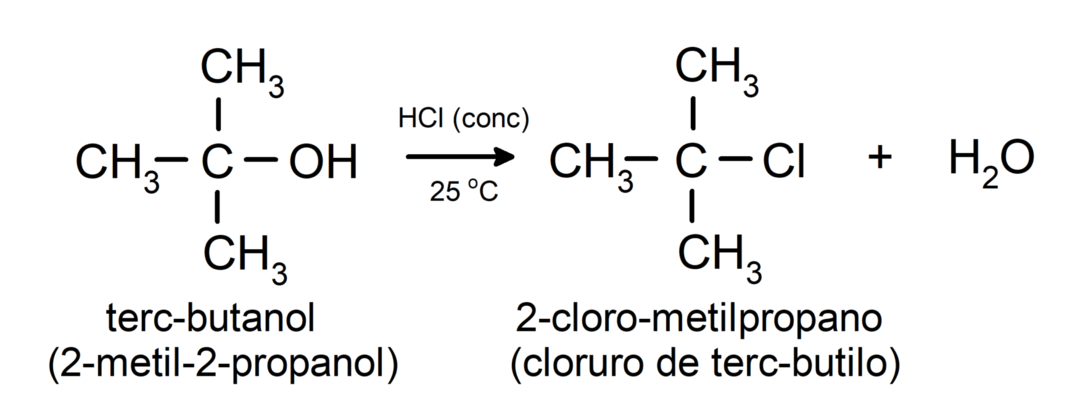
-
Спирти вступають в реакції окислення коли вони реагують з деякими окисними сполуками. Продукти реакцій окислення залежать від типу спирту, що реагує, тобто первинного, вторинного чи третинного.
Окислення первинного спирту з утворенням альдегіду або карбонової кислоти.
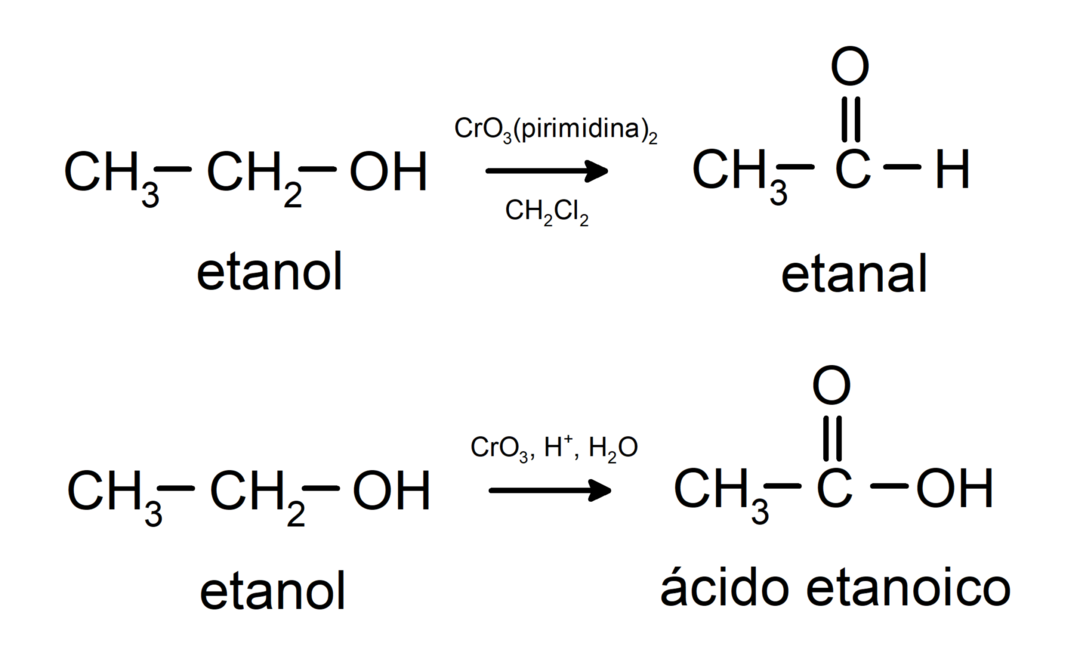
Окислення вторинного спирту з утворенням кетону.
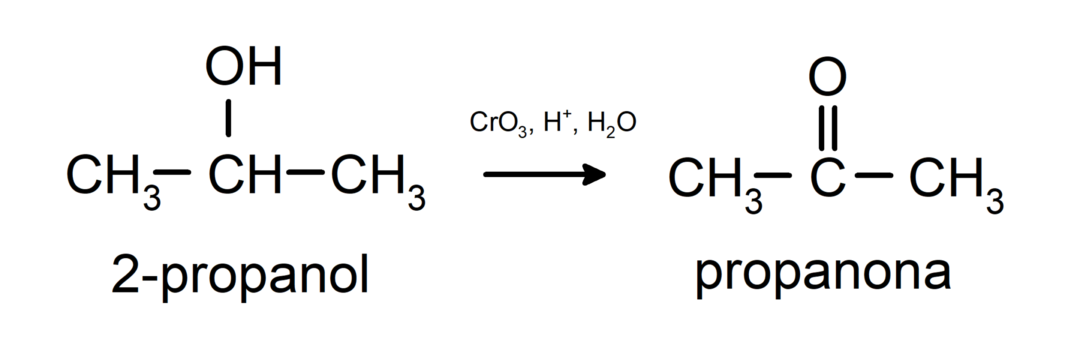
Третинні спирти не окислюються звичайними окислювачами. За допомогою дуже сильних окислювачів вони можуть бути перетворені в алкени, які потім можуть бути окислені.
Спирти, які мають дві гідроксильні групи, розташовані на сусідніх атомах вуглецю, окислюються тетраацетатом свинцю з утворенням двох кетонів.
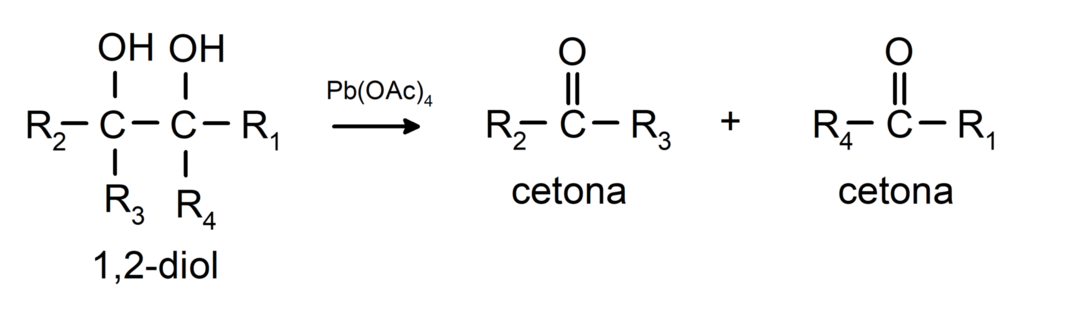
- Спирти піддаються реакціям дегідрування. Ці реакції відбуваються лише з первинними та вторинними спиртами, які під впливом високих температур у присутності каталізаторів виділяють водень.
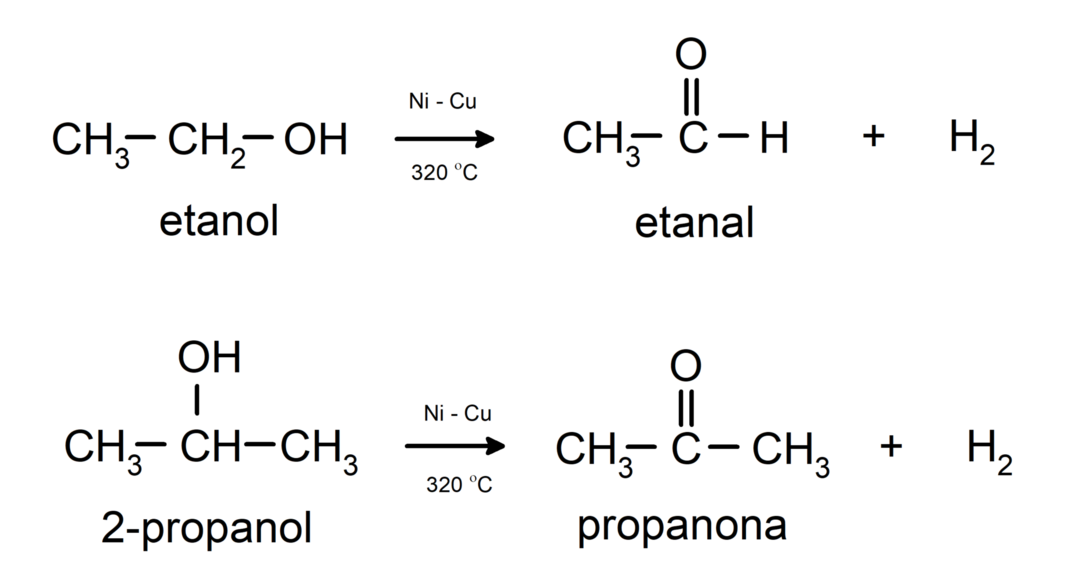
- Спирти піддаються реакції дегідратації. Спирти дегідратують з утворенням відповідних алкенів. Ця реакція відбувається в присутності кислоти і проміжних температур.
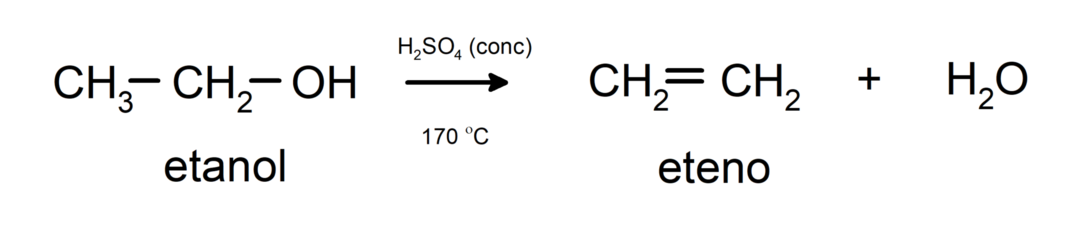
Номенклатура спирту
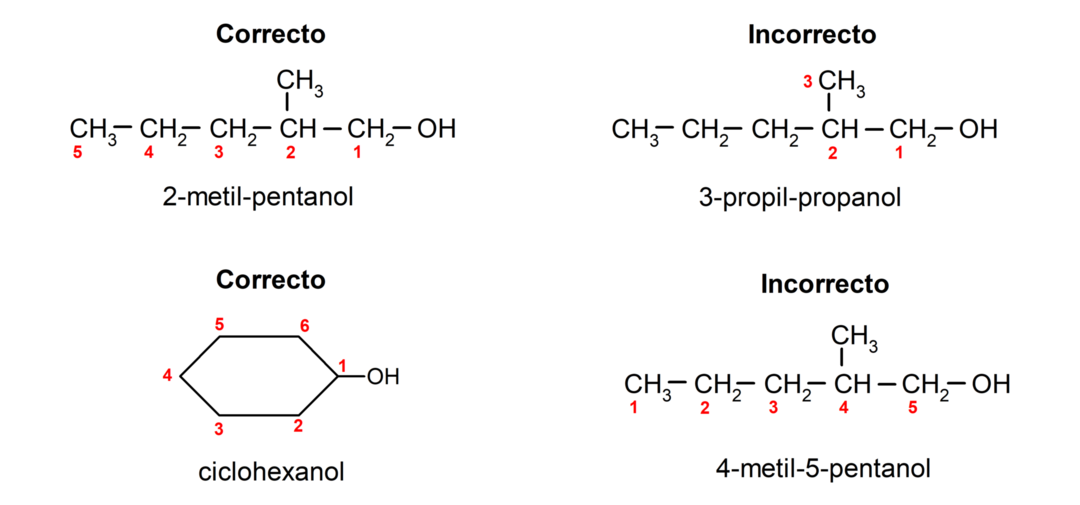
Згідно з номенклатурою, встановленою IUPAC (Міжнародним союзом теоретичної та прикладної хімії), спирти називаються за такими правилами:
- Положення гідроксильної групи вибирають з урахуванням того, щоб вона займала найменше можливе число в карбоновому ланцюзі. Якщо структура спирту є циклічною, розглядається позиція 1 вуглецю, до якого приєднана гідроксильна група, і для її назви використовується префікс цикло-.
- Назву спирту пишуть за допомогою префіксів, що вказують на кількість атомів у вуглецевому ланцюзі, а крім того, ставиться суфікс -ол.
- Якщо структура спирту має розгалуження, то основним вуглецевим ланцюгом вибирають найдовший ланцюг, який також містить гідроксильну групу.
Згідно з традиційною номенклатурою, спирти називаються шляхом написання слова «алкоголь», а потім — назви алкоголю. алкан, що відповідає вуглецевому ланцюгу, але замість закінчення -ane алкану, закінчення -ілличний.
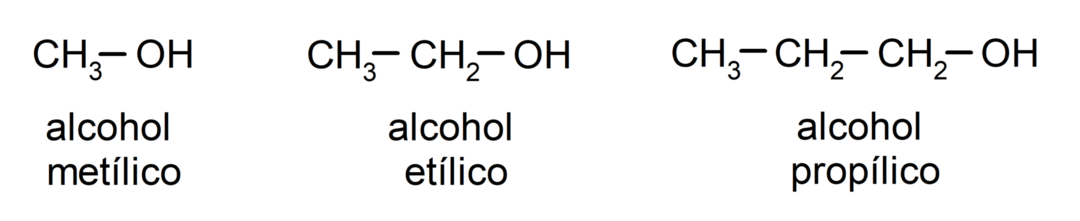
Приклади спиртів
- метанол
- етанол
- 1-пропанол
- 2-пропанол
- 1-бутанол
- 3-етилгексан-2-ол
- гліцерин
- фенол
- 2-метил-2-бутанол
- 1,2-етандіол
- 1,5-гептадієн-3-ол
- 3-метил-2-бутанол
- бензилметанол
- 3-пентанол
- 2-метилфенол
- 1,2-дигідроксифенол
- циклогеакнол
- 1-фенілетанол


Вживання алкоголю
Найбільш поширені способи використання алкоголю:
- Їх використовують як дезінфікуючі та антисептичні засоби, оскільки вони зупиняють ріст деяких мікроорганізми або знищити їх. Найчастіше для цього використовують етанол і ізопропіловий спирт.
- Їх використовують при синтезі різн хімічні сполуки. Метанол, наприклад, використовують для отримання метаналя (формальдегіду).
- Їх використовують для виробництва антифризу. Метанол є одним з найбільш використовуваних для цієї мети.
- Вони використовуються як розчинники у фармацевтичній промисловості. Етанол є одним з найбільш використовуваних в цьому сенсі.
- Вони використовуються як розчинники для лаків, барвників і чорнила. Для цього широко використовується метанол.
- Вони використовуються як паливо, і існує важлива тенденція до часткової заміни використання горючі корисні копалини з використанням палива біоетанолу.
- З них виготовляють смоли. У цьому значенні використовується фенол.
Шкода вживання алкоголю
Незважаючи на те, що сьогодні вживання алкоголю є суспільно прийнятним, зловживання цією речовиною породжує залежність і звикання.
Етанол - це алкоголь, присутній в алкогольних напоях, який при надмірному вживанні впливає когнітивні здібності та може спричинити серцево-судинні захворювання, цироз печінки та рак.
Крім того, при досягненні ступеня алкогольного сп'яніння, тобто стану сп'яніння, якщо доза алкоголю занадто багато, може виникнути алкогольна кома, яка може призвести до паралічу дихання і навіть смерті. смерть.
Список літератури
- Т. ДО. Гайсмана. (1974) «Принципи органічної хімії», друге видання. Editorial Reverté, S.A. ISBN: 8429171800
- Ахумада-Кортес, Дж. Г., Гамес-Медіна, М. Е. та Вальдес-Монтеро К. (2017). Вживання алкоголю як проблема громадського здоров'я. Ра Ксімхай, 13(2), 13-24.
- Моррісон, Р. Т. і Бойд Р. Н. (1998). Органічна хімія. Освіта Пірсона.
- Вайнінгер, С. Дж. і Стерміц Ф. Р. (1988). Органічна хімія. Я повернув назад.
Дотримуйтеся:
- Спирт етиловий
- Палива
- органічна хімія
