30 прикладів бінарних продажів
Приклади / / November 09, 2023
The бінарні солі (нейтральні солі) утворюються при поєднанні металу та неметалу. Є хімічні сполуки складається лише з двох хімічні елементи. Наприклад: хлорид натрію (NaCl) і бромід калію (KBr).
- Дивись також: Метали і неметали
Приклади подвійних солей
- Хлорид натрію (NaCl)
- Хлорид заліза (II) (FeCl2)
- Хлорид заліза (III) (FeCl3)
- Сульфід кобальту(II) (CoS)
- Сульфід кобальту (III) (Co2Так3)
- Сульфід свинцю (II) (PbS)
- Сульфід свинцю(IV) (PbS2)
- Хлорид кальцію (CaCl2)
- Фторид натрію (NaF)
- Хлорид літію (LiCl)
- Хлорид стронцію (SrCl2)
- Хлорид барію (BaCl2)
- Хлорид алюмінію (AlCl3)
- Сульфід магнію (MgS)
- Хлорид рубідію (RbCl)
- Бромід кальцію (CaBr2)
- Сульфід калію (К2S)
- Бромід магнію (MgBr2)
- Сульфід цинку (Zn2S)
- Бромід літію (LiBr)
- Хлорид нікелю (NiCl2)
- Хлорид урану (III) (UCl3)
- Бромісте срібло (AgBr)
- Йодисте срібло (AgI)
- Бромід калію (KBr)
Номенклатура бінарних солей
Згідно з традиційною номенклатурою, подвійні солі називаються шляхом написання назви неметалічного елемента із закінченням -ід. З іншого боку, назва металічного елемента записується відповідно до його ступеня окислення:
- Для найнижчого ступеня окислення його записують із закінченням -осо. Наприклад: хлорне залізо (FeCl2), де залізо має ступінь окислення 2+.
- Для найвищого ступеня окислення його записують із закінченням -ico. Наприклад: хлорне залізо (FeCl3), де залізо має ступінь окислення 3+.
Відповідно до Систематичної номенклатури, подвійні солі називають, записуючи назву неметалічного елемента з префіксом, який вказує на кількість атомів цього елемента в сполуці. Крім того, закінчення -уро ставиться в назві неметалічного елемента. Потім ставиться назва металевого елемента. Наприклад: дихлорид магнію (MgCl2) і трихлорид заліза (FeCl3).
Відповідно до номенклатури Стока, бінарні солі називаються шляхом написання назви неметалічного елемента із закінченням -ide. Потім після назви металічного елемента вказується його ступінь окиснення римськими цифрами та в дужках. Наприклад: ферум(II) хлорид (FeCl2) і сульфід кобальту (III) (Co2Так3).
Застосування бінарних солей
- Вони використовуються як холодоагенти в харчовій і фармацевтичній промисловості. Наприклад: хлорид кальцію (CaCl2).
- Використовуються для обробки металевих поверхонь від корозії. Наприклад: фторид натрію (NaF).
- Вони використовуються для регулювання вологості в паперовій та будівельній промисловості. Наприклад: хлорид кальцію (CaCl2).
- Вони використовуються в скляній промисловості для видалення домішок. Наприклад: тетрахлорид кремнію (SiCl4).
- Їх використовують як інгредієнти для приготування їжі. Наприклад: хлорид натрію (NaCl).
Фізичні властивості подвійних солей
- Вони мають високі температури плавлення, оскільки складаються з іонні зв'язки.
- Вони проводять електричний струм у розчиненому або розплавленому стані.
- Найпоширеніші солі мають низьку твердість.
- Вони не стискаються.
- Більшість може розчинятися у воді.
Як отримують бінарні солі?
Бінарні солі можна отримати за допомогою деяких із наведених нижче хімічних реакцій:
Реакція між металом і неметалом. Наприклад: реакція між натрієм (Na) і дихлоридом (Cl2) утворює хлорид натрію (NaCl).
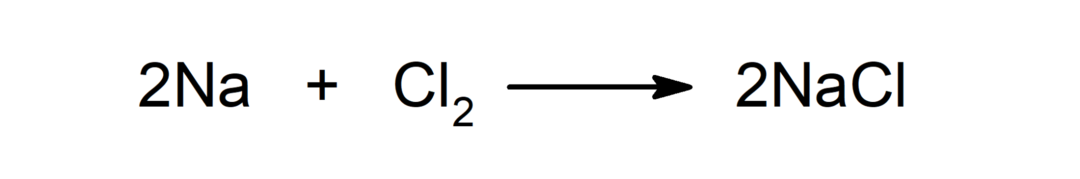
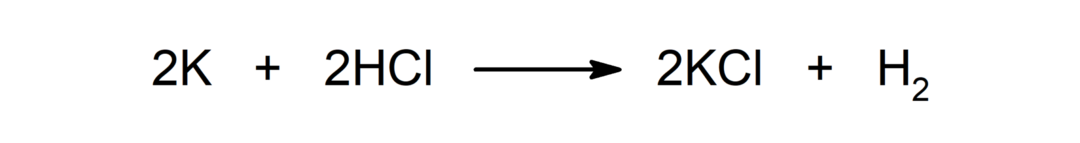
Реакція між металом і кислотою. Наприклад: Реакція між калієм (K) і соляною кислотою (HCl) утворює хлорид калію (KCl) і дигідроген (H2).
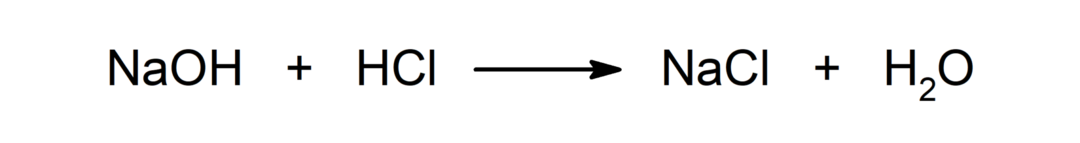
Реакція між кислотою і основою. Наприклад: Реакція між соляною кислотою (HCl) і гідроксидом натрію (NaOH) утворює хлорид натрію (NaCl) і воду (H2АБО).
Дотримуйтеся:
- оксисолі
- нейтральні солі
- кислі солі
Список літератури
- Серон Вільяльба, А., Новоа Рамірес, К. С. та Альпісар Хуарес Е. (2020). Номенклатурне відео 1: бінарні солі та хімічна реакція.
- Акуріо Аріас, М. В. та Дельгадо Мендес М. І. (2022). Ігровий навчальний посібник для «бінарних сполук» у середній школі з хімії в навчальному підрозділі «Herlinda Toral» (Бакалаврська робота, НПУ).
- Кабрера, М. Дж. Х. (2005). Вивчення перших принципів електронних і структурних властивостей бінарних і потрійних сполук (Докторська дисертація, Університет Ла-Лагуна).



