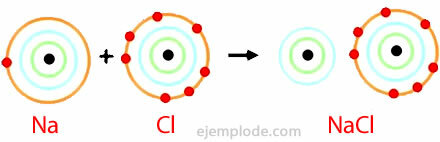
Приклад йонічного зв’язку
Хімія / / July 04, 2021
Іонний зв’язок визначається наявністю катіону та аніону, хімічних речовин з електричними зарядами протилежних знаків. Він визначається як електростатична сила, яка пов'язує іони в іонній сполуці.
Атоми елементів з низькою енергією іонізації мають тенденцію утворювати катіони. На відміну від них, люди з високою спорідненістю до електронів, як правило, утворюють аніони.
Лужні та лужноземельні метали частіше утворюють катіони в іонних сполуках, а галогени та кисень найчастіше утворюють аніони. Як наслідок, композиція великого різноманіття іонних сполук є результатом поєднання металу групи IA або IIA групи та галогену або кисню.
Наприклад, в результаті реакції між літієм та фтором утворюється фторид літію, отруйний білий порошок, який використовується для зниження температури плавлення припою та у виробництві кераміки. Електронна конфігурація літію дорівнює 1s2, 2 с1, а фтору - 1 с2, 2 с2, 2 с5. Коли ці атоми контактують, валентний електрон 2s1 Літій переноситься в атом фтору.
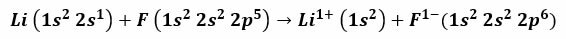
Правильно припустити, що процедура починається з відриву електрона літію, іонізуючи його, щоб досягти позитивної валентності 1+. Це продовжується з прийомом цього електрону Фтором, що дає йому негативний заряд. Зрештою, утворення іонного зв’язку відбувається шляхом електростатичного притягання. Фторидна сполука літію буде електрично нейтральною.
Багато загальних реакцій призводять до утворення іонних зв’язків. Наприклад, при спалюванні кальцію в кисні утворюється оксид кальцію:
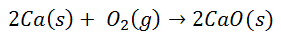
Двоатомна молекула кисню розділяється на два окремі атоми. Тоді відбудеться перенесення двох електронів від атома кальцію до кожного атома кисню. Потім обидва матимуть відповідні заряди: для кальцію 2+ для кожного атома та для кисню 2 - для кожного атома. Після остаточного зв’язку молекула оксиду кальцію є електрично нейтральною.
Енергія решітки іонних сполук
За значеннями енергії іонізації та спорідненості до електронів елементів можна передбачити, що елементи утворюють іонні сполуки, але також необхідно оцінити стабільність цього типу сполуки.
Енергія іонізації та спорідненість до електронів визначені для процесів, що відбуваються в газовій фазі, хоча всі іонні сполуки тверді при 1 атмосфері тиску і 25 ° С. Твердий стан - це зовсім інший стан, оскільки кожен катіон оточений певною кількістю аніонів і навпаки. Отже, загальна стабільність твердої іонної сполуки залежить від взаємодії всіх іонів, а не лише від взаємодії катіона з аніоном.
Кількісною мірою стійкості будь-якої іонної твердої речовини є її енергія решітки, який визначається як Енергія, необхідна для повного розділення моля твердої іонної сполуки на її іони в газоподібному стані.
Цикл Борна-Габера для визначення енергії решітки
Неможливо безпосередньо виміряти енергію решітки. Однак, якщо будова та склад іонної сполуки відомі, можна розрахувати енергію її решітки, застосовуючи закон Кулона, який стверджує, що потенційна енергія між двома іонами прямо пропорційна добутку їх зарядів і обернено пропорційна відстані між ними. Зупинитися.
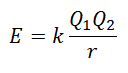
Оскільки заряд катіона позитивний, а заряду аніона негативний, продукт дасть негативний результат в енергії. Це являє собою екзотермічну реакцію. Отже, для зворотного процесу необхідно подавати енергію.
Також можливо побічно визначити енергію решітки, якщо передбачається, що іонна сполука утворюється за кілька етапів. Ця процедура відома як Цикл Борна-Габера, який пов'язує енергію решітки іонних сполук з енергіями іонізації, електронною спорідненістю та іншими атомними та молекулярними властивостями. Цей метод базується на Законі Гесса алгебраїчної суми хімічних реакцій і був розроблений Максом Борном та Фріцем Хабером. Цикл Борна-Габера визначає різні стадії, які передують утворенню іонної твердої речовини.

Хлористий натрій
Хлорид натрію - це іонна сполука з температурою плавлення 801 ° С, яка проводить електрику в розплавленому стані та у водному розчині. Кам’яна сіль є одним із джерел хлориду натрію і знаходиться в підземних відкладах, товщина яких часто становить кілька сотень метрів. Хлорид натрію також отримують з морської води або з розсолу (концентрованого розчину NaCl) шляхом сонячного випаровування. Крім того, він міститься в природі в мінералі під назвою халіт.

Хлорид натрію використовується більше, ніж будь-який інший матеріал для виготовлення неорганічних хімічних сполук. Світове споживання цієї речовини становить близько 150 мільйонів тонн на рік. Хлорид натрію використовується головним чином для виробництва інших неорганічних хімічних сполук, таких як хлорний газ, гідроксид натрію, металевий натрій, газоподібний водень та карбонат натрію. Застосовується також для танення льоду та снігу на автомагістралях та дорогах.