Приклад об'ємного аналізу
Хімія / / July 04, 2021
Увімкнено Аналітична хімія, Об'ємність - це метод аналізу, який складається з Вимірювання об'єму реагенту, необхідного для стехіометричної реакції з аналітом, яка речовина визначається.
Реагуйте стехіометрично відноситься до речовин, що взаємодіють хімічно, згідно з пропорція, що позначає хімічне рівняння вже збалансований.
Речовина, яку слід дослідити, називається Аналіт. Відомий і точно виміряний об’єм буде взятий за зразок цієї речовини, який ми і назвемо Аліквотна, що міститься в колбі Ерленмейера для початку аналізу.
Поняття об'ємного аналізу
Об'ємний аналіз, як різновид Хімічний аналіз, нести беруть участь хімічна реакція. Ця хімічна реакція буде проводитися між зразком з невідомою кількістю досліджуваної речовини та відомою кількістю іншої речовини, здатної реагувати з першою.
Реакційні речовини будуть у водному розчині, а обсяги розчинів, які взаємодіяли до кінця реакції, будуть виміряні, що буде видно завдяки індикатору, який надаватиме кольору всередині колби.
В об'ємному аналізі водний розчин
Відома концентрація називається стандартним розчином, Стандарт або титрант, і служитиме еталоном для закінчення реакції, щоб зробити розрахунок, який покаже кількість досліджуваної речовини.Ця процедура змушення обох розчинів реагувати називається Хімічний ступінь o Оцінка, яка є основною частиною об'ємного аналізу. Складається з поїздки поступово розливаючи Стандартний розчин (Титрант) в аліквоті (Зразок), поки індикатор не відображатиме зміни з різницею кольорів.
A Показник Це хімічна речовина, яку додають до аліквоту, проявляючи забарвлення, і коли реакція закінчиться, вона змінить колір.
Об'ємний аналіз складається з простої серії кроків:
1. - Приготування стандартного розчину
2. - Приготування зразка або аликвоти
3. - Хімічний ступінь
4.- Вимірювання обсягу
5.- Розрахунок досліджуваної речовини.
До того, що вони вже це зробили повністю відреагував дві речовини, це називається Точка еквівалентності.
Як і в будь-якому хімічному методі аналізу, в об'ємному аналізі є вимоги до гарних результатів:
-Хімічна реакція повинна бути Вибірковий, тобто стандартний розчин реагуватиме лише із зразком.
-Хімічна реакція повинна бути Стехіометричний, тобто дотримуватися пропорцій, позначених у збалансованому хімічному рівнянні.
-Хімічна реакція повинна бути Кількісний; відноситься до 99,9% завершення в точці еквівалентності.
-Має бути a виявляється кінцева точка реакції, що буде краще підтверджено показником.
Первинний візерунок
Первинні візерунки Це речовини високої чистоти, концентрація яких у розчині обчислюється безпосередньо за зваженою кількістю та об’ємом води, що використовується.
А) Так, може реагувати робочими розчинами, щоб знати концентрації останніх і перетворювати їх у стандартні розчини.
Прикладами первинних зразків є:
-Карбонат натрію (Na2CO3): Використовується для стандартизації кислот, таких як Сірчана кислота.
-Біфталат калію: Це основний стандарт для приготування стандартних розчинів основ, таких як гідроксид натрію.
-Хлорид натрію (NaCl): Він використовується для стандартизації розчинів нітрату срібла.
-Карбонат кальцію (CaCO3): Первинний стандарт для ЕДТА (етилендіамін тетраоцтова кислота).
Первинний шаблон повинен відповідати декільком основним характеристикам:
Повинен мати Висока чистота, Стійкість атмосфери, Відсутність води для гідратації, Невисока вартість і її легко отримати, Y Висока еквівалентна вага.
Класифікація об'ємного аналізу
Залежно від виду хімічної речовини, з якою ви працюєте для аналізу, це буде тип волюметрії:
Кислотно-основна об'ємність: Він працює або з кислотою, або з основою для аналізу зразків, що містять кислоти або основи.
Об'єм опадів: Його також називають аргентометрією, він використовує стандартний розчин нітрату срібла для визначення кількості хлоридів у зразку.
Об'ємність складності: Для вимірювання концентрації твердості, тобто карбонатів кальцію та магнію, у воді використовується стандартний розчин комплексоутворювача, такий як ЕДТА.
Об'єм REDOX: Реакція відбувається між окислювальною речовиною та відновлюючою речовиною.
Показники
З численних показників, що використовуються у волюметриці, виділяються три:
1.- Метиловий апельсин: Це вимагає помаранчевого забарвлення в аликвоті, яка буде титруватися кислотою. Коли точка еквівалентності досягнута, індикатор стане жовтим.
2.- Фенолфталеїн: На початку він прозорий в аліквоті, яка буде названа основою. Коли точка еквівалентності буде досягнута, індикатор стане рожевим.
3.- Еріохромний чорний: Це показник, який використовується для визначення твердості води. На початку в аликвоті він фіолетовий, поки не титрується комплексоутворювачем. В кінці реакції вона набуває синього кольору.

Прилади в об'ємному аналізі
В об'ємному аналізі буде використана серія інструментів, які, якщо вони недоступні, не можуть бути адекватно розроблені:
1. - Мірна колба: Це ємність, подібна до цибулини в нижній частині, сплющена внизу, яка має тонку колонку, в яку додається рідина. На ньому є позначка, яка вказує, де повинен знаходитися меніск рідини, щоб він охоплював точний об’єм. Він використовується, щоб містити Стандартні рішення; завдяки точності його обсягу забезпечується відома концентрація.

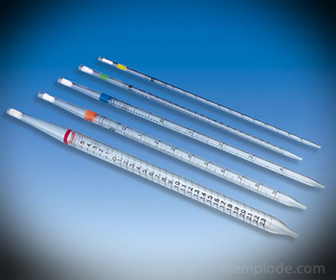
2.- Піпетки: Це градуйовані тонкі пробірки, які дозволяють надійно виміряти точну кількість рідини. Вони доступні до 25 мілілітрів і дозволяють проводити точну вибірку.
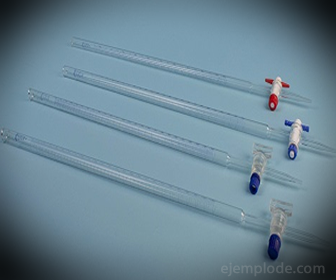
3. - Бюретка: Це витягнута трубка ємністю 50 мілілітрів, яка буде містити стандартний розчин. На одному з його кінців він має клапан регулювання потоку, який буде зливати розчин в аліквоту.
4. - колби Ерленмейера: це контейнери з плоскою основою, конічної форми, яка закінчується циліндричним краєм. Ця конструкція робить їх придатними для хімічного титрування, оскільки вони не дозволяють струшуванню розчинів переливати їх. Для повторного тестування потрібно забезпечити мінімум три, щоб забезпечити надійний результат.

Розрахунки в об'ємному аналізі
Під час обробки водних розчинів для об'ємного аналізу важливими величинами є концентрація та об'єм.
Основне рівняння об'ємності базується на чотирьох основних даних:
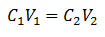
C.1= Концентрація зразка (невідомо)
V1= Обсяг аликвоти, з якою проводився аналіз
C.2= Концентрація стандартного розчину, що використовується для досягнення точки еквівалентності
V2= Об'єм Стандартний розчин, необхідний для досягнення кінця реакції
Дані підставляються у рівняння, залишаючи невідомою лише шукану концентрацію. Звичайно, всі дані повинні бути на одних і тих же дисках.
Приклади об'ємного аналізу
Визначення хлоридів (Cl-) методом аргентометрії з нітратом срібла.
Визначення бромідів (Br-) методом аргентометрії з нітратом срібла.
Визначення ціанідів (CN-) методом Аргентометрії з нітратом срібла.
Визначення карбонату магнію (MgCO3), за допомогою комплексометрії, з ЕДТА.
Визначення карбонату кальцію (CaCO3), за допомогою комплексометрії, з ЕДТА.
Аналіз сірчаної кислоти (H2SW4) з гідроксидом натрію (NaOH).
Аналіз гідроксиду натрію (NaOH) із соляною кислотою (HCl).
Визначення сурми (III) за допомогою перманганату калію (KMnO4).
Визначення миш'яку (III) за допомогою перманганату калію (KMnO4).
Визначення титану (III) за допомогою перманганату калію (KMnO4).
Визначення молібдену (III) за допомогою перманганату калію (KMnO4).
Визначення заліза (II) за допомогою перманганату калію (KMnO4).
Визначення оксалат-іона з перманганатом калію (KMnO4).