Приклад ідеальних та реальних газів
Фізика / / July 04, 2021
A Ідеальний газ це той, чиї властивості люблять Покритий тиск, температура та об’єм, вони зберігають завжди пропорція або постійні стосунки між ними. Іншими словами, його поведінка відповідає Закону про ідеальний газ, який представлений таким чином:
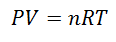
Щоб дійти до цієї формули, ми починаємо з Ла Загальний закон газоподібної держави, який описує, що існує постійний зв’язок між властивостями газу в будь-який час процесу. Властивості, про які говорять, це Тиск в системі, де знаходиться газ, Гучність що займає газ, і Температура газу.
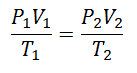
Рано чи пізно було вирішено сформувати простіший вираз, надавши постійності букву, що супроводжує вираз:
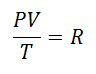
Це називалося Універсальна газова постійна при коефіцієнті R, і його значення таке:
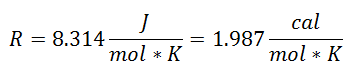
І оскільки універсальна газова постійна застосовується до кожного моля газу, то Кількість молей газу як ще один фактор, щоб охопити всі речовини, присутні в системі під час процесу. Ми вже матимемо остаточне рівняння у такому вигляді:
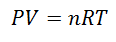
Вищевказане рівняння є Закон про ідеальний газ, і стосується газів, які мають температуру від помірної до високої. Таким чином, будь-яку зі змінних можна обчислити, визначивши інші.
Різниця між ідеальними газами та реальними газами
Цей закон про ідеальний газ не застосовується для газів, які знаходяться на низькі температури або близько до точки, де вони стають рідкими.
Низькі температури призводять до менше руху частинок газу, і вони будуть осідати більше, займаючи інший об’єм, ніж тоді, коли вони були повністю розпорошені.
Крім того, з тієї самої причини вони здійснювали б Нерівномірний тиск у системі. Пропорційність почне давати збій, і формула не матиме однакової дійсності для розрахунків.
У цьому випадку слід використовувати рівняння для реальних газів.
A Справжній газ є той, чиї властивості вони не дотримуються точних відносин як у Законі про ідеальний газ, так і спосіб обчислення цих властивостей модифікується.
Рівняння стану для реальних газів
1. - Вірусне рівняння:
Для газу, який залишається на рівні Постійна температура, залежність між тиском і об'ємом або тиском і питомим об'ємом (об'ємом, зайнятим кожною одиницею маси газу).
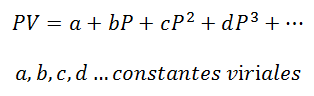
Вірусні константи - це характеристики кожного газу з конкретними значеннями, які залежать від температури.
Можна робити лише розрахунки тиску та обсягу; Температуру попередньо визначають, спостерігаючи за процесом. Для цих розрахунків змінні віріального рівняння очищаються:
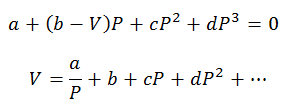
Віріальні константи для розв’язання рівнянь отримують із спеціалізованих таблиць.
2.- РівнянняВан дер Ваальс про:
Рівняння Ван-дер-Ваальса - ще один вираз, що використовується для обчислення властивостей реального газу, і, як і рівняння Віріала, він також вимагає його констант:

Константи також запитуються в таблицях.
3.- РівнянняРедлі наЧ-Квонг:
Це рівняння дуже добре працює для обчислення газів практично при будь-якій температурі та середньому тиску, але не надто високих, таких як сотні атмосфер.
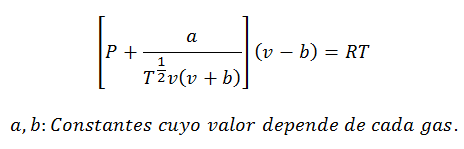
Константи також запитуються в таблицях.
Ви можете очистити тиск, температуру та об’єм, щоб зробити свої розрахунки. Зазори залишаються:
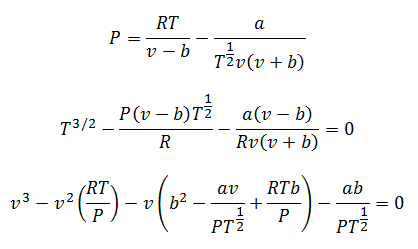
4. Рівняння Бертело:
За допомогою цього рівняння можна обчислити будь-яку змінну. Тільки він має два різних режими: для низького тиску та для високого тиску.
Для низького тиску:

Для високого тиску:
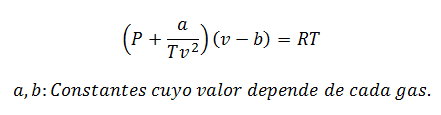
Константи також запитуються в таблицях.
5.-Рівняння коефіцієнта стисливості
Це рівняння є більш простим варіантом Закону про ідеальний газ; додається лише фактор "z", який називається коефіцієнтом стисливості. Цей коефіцієнт отримують із графіку узагальнених коефіцієнтів стисливості залежно від температури, тиску або конкретного обсягу, залежно від того, що доступно.
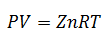
Приклади ідеальних та реальних газів
Як ідеальний чи реальний персонаж Це залежить від умов тиску, температури, в якій знаходиться газ, Неможливо скласти обмежений перелік, тому представлений перелік газів, які, звичайно, можна знайти в ідеалі та реальності.
- Аміак
- Холодоагент R134 (DiFluoroDiCloro Ethane)
- Вуглекислий газ
- Окис вуглецю
- Кисень
- Азот
- Гідроген
- Діоксид азоту
- Тріоксид азоту
- П'ятиокис азоту
- Гептоксид азоту
- Діоксид сірки
- Тріоксид сірки
- Хлор
- Гелій
- Неон
- Аргон
- Криптон
- Ксенон
- Метан
- Етан
- Пропан
- Бутан



