50 أمثلة على الحلول
منوعات / / July 04, 2021
ال حلول هي أحد أنواع مخاليط هذا المخرج. لا تتفاعل المكونات التي يتكون منها الحل كيميائيًا ، على الرغم من إمكانية تعديل الخصائص الفيزيائية لهذه المكونات عندما تصبح جزءًا من المحلول. على سبيل المثال: الدخان والملغم والقهوة بالحليب.
لكي يكون الخليط حلاً ، يجب أن يكون كذلك متجانس ص زي موحدأي أنه لا يمكن تمييز المكونات المختلطة بالعين المجردة وأنه بالإضافة إلى ذلك ، فإن النسبة بين المذاب (المادة التي تظهر بكمية أقل) و مذيب (المادة التي تظهر بكميات أكبر) تظل دون تغيير تقريبًا في أي حجم مأخوذ من المحلول. نسبة المذاب في المحلول أو في المذيب هو ما يسمى "التركيز" وعادة ما يمكن تحضير نفس المحلول باستخدام تركيزات مختلفة من المذاب.
يمكن أن تتشكل المحاليل بين المواد التي ، قبل خلطها ، تكون في أي من المواد المختلفة الدول التجميعية. توجد حلول في جميع حالات التجميع تقريبًا. بشكل عام ، يتم تحديد حالة تجميع المحلول من خلال حالة تجميع المذيب. على سبيل المثال:
من الشائع ل وجود الجزيئات من المذاب داخل مذيب يغير خصائص المذيب نفسه. على سبيل المثال ، تتغير نقاط الانصهار والغليان لمركبين عند خلط هذين المركبين ، كما يتغير تكوينهما. كثافات والألوان.
العالم الفرنسي رولت درس هذا السلوك للمكونات في الحلول واقترح أيضًا قانونه الأساسي (قانون رولت) ، والتي تنص على أن ضغط البخار الجزئي لكل مكون في خليط البخار المحيط بمحلول مثالي من عند السوائل إنه يساوي الضغط الجزئي لكل مكون نقي مضروبًا في الكسر الجزيئي في المحلول. يعتبر الحل المثالي هو الحل الذي تكون فيه الأنواع الكيميائية متشابهة جدًا ، لذلك لا يؤخذ في الاعتبار أي اختلاف في طاقة التفاعلات بينهما. المعادلة الأساسية لقانون رولت هي:
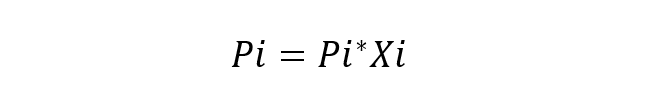
أين:
- بي هو الضغط الجزئي للمكون أنا في الخليط الغازي المحيط بالمحلول.
- باي * هو ضغط المكون أنا
- شي هو جزء الخلد من المكون أنا في الانحلال.
من الواضح أن الناس على اتصال دائم بالحلول. ال هواء هو انحلال العناصر في الحالة الغازية: يتم إعطاء تكوين الأغلبية من قبل نتروجين (78٪) والباقي 21٪ من الأكسجين و 1٪ من المكونات الأخرى ، على الرغم من أن هذه النسب قد تختلف قليلاً.
أمثلة على الحلول
تتضمن القائمة التالية أربعين مثالاً للحلول ، مع تسليط الضوء على حالة التجميع التي يوجد فيها كل واحد ، مذاب في مذيب خاص.
- هواء (غاز في الغاز). تركيبة من الغازات ، حيث يكون النيتروجين هو الأكثر وفرة.
- دخان (صلب في الغاز). الهواء رديء بسبب ظهور دخان من النار. إنه حل يعمل فيه الهواء كمذيب.
- السبائك بين المعادن (صلب في صلب). Duralumin عبارة عن سبيكة تتكون من الألومنيوم والنحاس والمنغنيز والمغنيسيوم والسيليكون.
- غبار الهواء الجوي (صلب في الغاز). يعد وجود المواد الصلبة (المتحللة تقريبًا إلى وحدة غير قابلة للتجزئة ولكن في النهاية صلبة) في الغاز مثالًا على الذوبان بهذا المعنى.
- صلب (صلب في صلب). سبيكة بين الحديد والكربون ، مع نسبة أعلى بكثير من السابق.
- المشروبات الكربونية (غاز في سائل). تحتوي المشروبات الغازية على إذابة الغازات في السائل.
- ملغم (سائل صلب). إنها سبائك من الزئبق مذابة بشكل معين المعادن مثل الذهب أو الفضة.
- بترول مكرر (سائل في سائل). مزيج العناصر المكونة له (الغالبية من الكربون) يؤدي إلى انحلال بين السوائل.
- البيوتان في الهواء (غاز في الغاز). البيوتان هو مركب كيميائي غازية يمكن تخزينها في أنابيب جاهزة لاستخدامها كوقود.
- الأكسجين في مياه المحيطات (غاز في سائل). تسمح أكسجة مياه البحر بتنمية الحياة المائية.
- المشروبات التي تحتوي على الكحول (سائل في سائل). يستهلكها البشر كثيرًا في الاحتفالات. عادة ما تكون محاليل الإيثانول وعصائر الفاكهة بتركيزات مضبوطة من كحول.
- قهوة مع الحليب (سائل في سائل). السائل ذو المحتوى الأعلى يتلقى القليل من الآخر ، مما يمثل تحولا في لونه ونكهته.
- الضباب الدخاني (غازات في غازات). يؤدي إدخال الغازات غير المعتادة في الغلاف الجوي إلى حدوث تحول في الهواء له آثار سلبية على المجتمعات التي تتنفسه: فكلما زاد تركيزه زاد ضرره.
- ملح في الماء (صلب في سائل). تستخدم على نطاق واسع للطبخ.
- الدم (سائل في سائل). المكون الأكبر هو البلازما (السائل) وداخلها تظهر عناصر أخرى ، من بينها خلايا الدم الحمراء.
- الأمونيا في الماء (سائل في سائل). هذا المحلول (الذي يمكن صنعه أيضًا من غاز إلى سائل) وظيفي للعديد من مستلزمات التنظيف.
- الهواء مع آثار الرطوبة (سائل في الغاز). بخار الماء موجود في الهواء بسبب الزيادة درجة الحرارة.
- عصائر بودرة (صلب في سائل). يذوب المسحوق في الماء وينتج محلول لون عصير البودرة.
- الهيدروجين في البلاديوم (غاز في صلب). يذوب الهيدروجين جيدًا في بعض المعادن.
- الفيروسات المحمولة جوا (صلب في الغاز). مثل الغبار الجوي ، فهي عبارة عن وحدات صغيرة جدًا من مادة صلبة يتم نقلها بواسطة الغاز.
- الزئبق بالفضة (سائل صلب). وهي واحدة مما يسمى "الحشوات".
- الشاي (صلب في سائل). مادة صلبة ذات أبعاد صغيرة جدًا (جرانيت الغلاف) تذوب في الماء.
- المياه الملكية (سائل في سائل). إنه تكوين من الأحماض يسمح بإذابة المعادن المختلفة ، من بينها الذهب.
- برونزية (صلب في صلب). إنها سبيكة بين النحاس والقصدير.
- عصير الليمون (سائل في سائل. على الرغم من أن الخليط يكون في كثير من الأحيان بين مادة صلبة وسائلة ، إلا أنه في الواقع سائل موجود في تلك المادة الصلبة ، مثل عصير الليمون.
- بيروكسيد (سائل في سائل). إنه محلول بيروكسيد الهيدروجين (H2أو2) في الماء. يتم استخدامه لتطهير الجروح وفي صناعة مستحضرات التجميل.
- نحاس (صلب في صلب). إنها سبيكة بين النحاس الصلب والزنك.
- تبريد الجليد (صلب في سائل). يدخل الثلج إلى السائل ويبرده أثناء الذوبان إذا تم إدخاله في الماء ، فهذه هي الحالة الخاصة التي تكون فيها نفس المادة.
- محلول فسيولوجي (سائل في سائل). يعمل الماء كمذيب والعديد من المواد السائلة تعمل كمذاب.
- سموثي (المواد الصلبة في السوائل). من خلال عملية الطحن ، يتم إحداث مزيج من المواد الصلبة إلى السوائل.
اتبع مع:


