30 أمثلة على المبيعات الثنائية
أمثلة / / November 09, 2023
ال أملاح ثنائية (أملاح محايدة) تتشكل عندما يتحد معدن مع غير معدن. نكون مركبات كيميائية مكونة من اثنين فقط العناصر الكيميائية. على سبيل المثال: كلوريد الصوديوم (NaCl) وبروميد البوتاسيوم (KBr).
- أنظر أيضا: المعادن وغير المعادن
أمثلة على الأملاح الثنائية
- كلوريد الصوديوم (NaCl)
- كلوريد الحديد الثنائي (FeCl2)
- كلوريد الحديد (III) (FeCl3)
- كبريتيد الكوبالت (II) (CoS)
- كبريتيد الكوبالت (III) (Co2نعم3)
- كبريتيد الرصاص الثنائي (PbS)
- كبريتيد الرصاص (IV) (PbS2)
- كلوريد الكالسيوم (CaCl2)
- فلوريد الصوديوم (NaF)
- كلوريد الليثيوم (LiCl)
- كلوريد السترونتيوم (SrCl2)
- كلوريد الباريوم (BaCl2)
- كلوريد الألومنيوم (AlCl3)
- كبريتيد المغنيسيوم (MgS)
- كلوريد الروبيديوم (RbCl)
- بروميد الكالسيوم (CaBr2)
- كبريتيد البوتاسيوم (ك2س)
- بروميد المغنيسيوم (MgBr2)
- كبريتيد الزنك (Zn2س)
- بروميد الليثيوم (LiBr)
- كلوريد النيكل (NiCl2)
- كلوريد اليورانيوم (III) (UCl3)
- بروميد الفضة (AgBr)
- يوديد الفضة (AgI)
- بروميد البوتاسيوم (KBr)
تسمية الأملاح الثنائية
وفقا للتسميات التقليدية، تتم تسمية الأملاح الثنائية عن طريق كتابة اسم العنصر غير المعدني مع النهاية -ide. ومن ناحية أخرى، يتم كتابة اسم العنصر المعدني حسب حالة الأكسدة الخاصة به:
- بالنسبة لأدنى حالة أكسدة، يتم كتابتها بالنهاية -oso. على سبيل المثال: كلوريد الحديدوز (FeCl2)، حيث الحديد لديه حالة الأكسدة 2+.
- للحصول على أعلى حالة أكسدة، يتم كتابتها بالنهاية -ico. على سبيل المثال: كلوريد الحديديك (FeCl3)، حيث الحديد لديه حالة الأكسدة 3+.
وفقا للتسمية المنهجية تتم تسمية الأملاح الثنائية عن طريق كتابة اسم العنصر غير المعدني ببادئة تشير إلى مقدار الذرات لهذا العنصر في المركب. بالإضافة إلى ذلك، يتم وضع النهاية -uro في اسم العنصر غير المعدني. ثم يتم وضع اسم العنصر المعدني. على سبيل المثال: ثنائي كلوريد المغنيسيوم (MgCl2) وثلاثي كلوريد الحديد (FeCl3).
وفقًا لتسمية ستوك، تتم تسمية الأملاح الثنائية عن طريق كتابة اسم العنصر غير المعدني مع النهاية -ide. ثم يوضع اسم العنصر المعدني متبوعًا بحالة الأكسدة الخاصة به مكتوبة بالأرقام الرومانية وبين قوسين. على سبيل المثال: كلوريد الحديد الثنائي (FeCl2) وكبريتيد الكوبالت (III) (Co2نعم3).
تطبيقات الأملاح الثنائية
- يتم استخدامها كمبردات في الصناعات الغذائية والصيدلانية. على سبيل المثال: كلوريد الكالسيوم (CaCl2).
- يتم استخدامها لمعالجة الأسطح المعدنية ضد التآكل. على سبيل المثال: فلوريد الصوديوم (NaF).
- يتم استخدامها لتنظيم الرطوبة في صناعة الورق والبناء. على سبيل المثال: كلوريد الكالسيوم (CaCl2).
- يتم استخدامها في صناعة الزجاج لإزالة الشوائب. على سبيل المثال: رابع كلوريد السيليكون (SiCl4).
- يتم استخدامها كمكونات الطبخ. على سبيل المثال: كلوريد الصوديوم (NaCl).
الخصائص الفيزيائية للأملاح الثنائية
- لها نقاط انصهار عالية لأنها تتكون من الرابطة الأيونية.
- تقوم بتوصيل التيار الكهربائي عندما تذوب أو تنصهر.
- الأملاح الأكثر شيوعًا لها صلابة منخفضة.
- فهي ليست قابلة للضغط.
- يمكن أن يذوب معظمها في الماء.
كيف يتم الحصول على الأملاح الثنائية؟
يمكن الحصول على الأملاح الثنائية من خلال بعض التفاعلات الكيميائية التالية:
التفاعل بين المعدن واللافلز. على سبيل المثال: التفاعل بين الصوديوم (Na) وثنائي كلوريد (Cl2) ينتج كلوريد الصوديوم (NaCl).
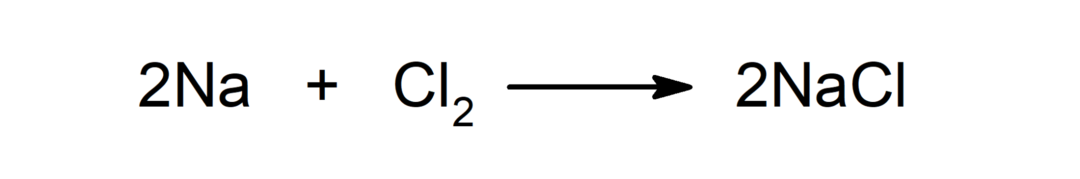
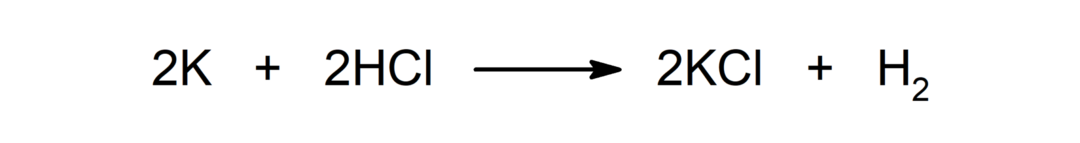
التفاعل بين المعدن والحمض. على سبيل المثال: التفاعل بين البوتاسيوم (K) وحمض الهيدروكلوريك (HCl) ينتج كلوريد البوتاسيوم (KCl) وثنائي الهيدروجين (H2).
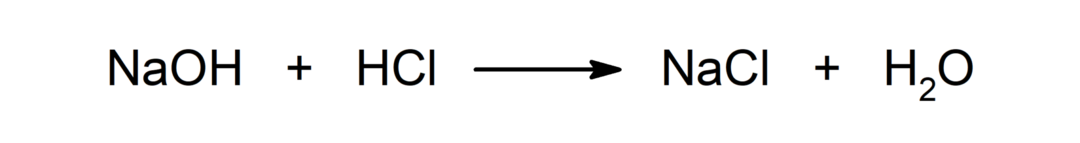
التفاعل بين الحمض والقاعدة. على سبيل المثال: التفاعل بين حمض الهيدروكلوريك (HCl) وهيدروكسيد الصوديوم (NaOH) ينتج كلوريد الصوديوم (NaCl) والماء (H)2أيضاً).
اتبع مع:
- أملاح الأكسجين
- أملاح محايدة
- أملاح حمضية
مراجع
- سيرون فيلالبا، أ.، نوفوا راميريز، ك. إس، وألبيزار خواريز، إي. (2020). فيديو التسميات 1: الأملاح الثنائية والتفاعل الكيميائي.
- أكوريو أرياس، M. V.، وديلجادو مينديز، M. و. (2022). دليل التعلم القائم على الألعاب لمادة "المركبات الثنائية" في الكيمياء بالمرحلة الثانوية بوحدة "هيرليندا تورال" التعليمية (أطروحة البكالوريوس، الجامعة الوطنية للتربية).
- كابريرا، M. ج. ح. (2005). دراسة من المبادئ الأولى للخصائص الإلكترونية والتركيبية للمركبات الثنائية والثلاثية (أطروحة دكتوراه، جامعة لا لاجونا).


