مثال التحليل الحجمي
كيمياء / / July 04, 2021
على كيمياء تحليلية، ال فولوميتري هي طريقة تحليل تتكون من قياس حجم الكاشف المطلوب للتفاعل مع التحليل الكيميائي، وهي المادة المراد تحديدها.
رد فعل متكافئ يشير إلى المواد التي تتفاعل كيميائيًا ، وفقًا لـ النسبة التي تميز المعادلة الكيميائية متوازنة بالفعل.
تسمى المادة المراد فحصها المحللة. من هذه المادة ، سيتم أخذ حجم معروف ومقاس بدقة كعينة ، والتي سنسميها قسامة، الموجودة في دورق إرلنماير لبدء التحليل.
مفاهيم التحليل الحجمي
التحليل الحجمي ، كونه نوعًا من تحليل كيميائي، احمل تنطوي على تفاعل كيميائي. يتم إجراء هذا التفاعل الكيميائي بين العينة بكمية غير معروفة من المادة التي تم فحصها ، وكمية معروفة من مادة أخرى ، قادرة على التفاعل مع الأولى.
ال ستكون مواد التفاعل في محلول مائي، وسيتم قياس أحجام الحلول التي تفاعلت للوصول إلى نهاية التفاعل ، والتي ستكون مرئية بفضل مؤشر سيعطي اللون داخل القارورة.
في التحليل الحجمي ، المحلول المائي لـ التركيز المعروف يسمى الحل القياسي, قياسي أو Titrant، وسيعمل كمرجع لإنهاء التفاعل ، لإجراء الحساب الذي سيكشف عن كمية المادة التي تم فحصها.
يسمى هذا الإجراء لجعل كلا الحلين يتفاعلان
الدرجة الكيميائية o التقييم ، وهو الجزء الأساسي من التحليل الحجمي. يتكون من الذهاب صب الحل القياسي تدريجيًا (تيتانت) في القسامة (عينة) ، حتى يظهر المؤشر التغيير مع اختلاف اللون.أ مؤشر إنها مادة كيميائية تضاف إلى القسامة ، تظهر لونًا ، وعندما ينتهي التفاعل ، يتغير لونها.
يتكون التحليل الحجمي من سلسلة بسيطة من الخطوات:
1.- إعداد الحل القياسي
2.- تحضير العينة أو القسامة
3.- درجة كيميائية
4.- قياس الحجم
5.- حساب المادة موضوع التحقيق.
إلى النقطة حيث لديهم بالفعل رد فعل كامل المادتين ، يطلق عليه نقطة التعادل.
كما هو الحال في أي طريقة كيميائية للتحليل ، في التحليل الحجمي هناك متطلبات للحصول على نتائج جيدة:
- يجب أن يكون التفاعل الكيميائي انتقائيأي أن الحل القياسي سيتفاعل فقط مع العينة.
- يجب أن يكون التفاعل الكيميائي متكافئ، أي اتباع النسب المحددة في المعادلة الكيميائية المتوازنة.
- يجب أن يكون التفاعل الكيميائي كمي; يشير إلى اكتمال بنسبة 99.9٪ عند نقطة التكافؤ.
-يجب أن يكون هناك ملف نقطة نهاية قابلة للكشف في رد الفعل، والتي سيتم تأكيدها بشكل أفضل من خلال المؤشر.
النمط الأساسي
ال الأنماط الأولية وهي مواد عالية النقاء يتم حساب تركيزها في المحلول مباشرة من الكمية التي يتم وزنها والحجم المستخدم من الماء.
أ) نعم ، يمكن أن تتفاعل مع حلول العمل، لمعرفة تراكيز الأخيرة وتحويلها إلى حلول قياسية.
أمثلة على الأنماط الأولية هي:
- كربونات الصوديوم (Na2كو3): يستخدم لتوحيد الأحماض مثل حامض الكبريتيك.
- بفتالات البوتاسيوم: وهو المعيار الأساسي لإعداد المحاليل المعيارية للقواعد مثل هيدروكسيد الصوديوم.
- كلوريد الصوديوم (NaCl): يستخدم لتوحيد محاليل نترات الفضة.
- كربونات الكالسيوم (CaCO3): المعيار الأساسي لـ EDTA (حمض الإيثيلين ديامين تتراسيتيك).
يجب أن يفي النمط الأساسي بعدة خصائص أساسية:
يجب أن يكون لديك عالية النقاء, استقرار الغلاف الجوي, نقص ماء الترطيب, منخفضة التكلفة وسهلة الحصول عليها، ص وزن مكافئ عالي.
تصنيف التحليل الحجمي
اعتمادًا على الأنواع الكيميائية التي تعمل بها لإجراء تحليل ، سيكون نوع قياس الحجم:
قياس الحجم الحمضي القاعدي: يعمل ، إما مع حمض أو مع قاعدة ، لتحليل العينات التي تحتوي على أحماض أو قواعد.
قياس حجم الهطول: يُعرف أيضًا باسم Argentometry ، ويستخدم محلولًا قياسيًا من نترات الفضة لتحديد عدد الكلوريدات في العينة.
حجم التعقيد: يتم استخدام محلول قياسي لعامل معقد ، مثل EDTA ، لقياس تركيز العسر ، أي كربونات الكالسيوم والمغنيسيوم ، في الماء.
قياس حجم REDOX: يحدث التفاعل بين مادة مؤكسدة ومادة مختزلة.
المؤشرات
من بين المؤشرات العديدة المستخدمة في المقاييس الحجمية ، تبرز ثلاثة منها:
1.- ميتيل برتقالي: يأخذ اللون البرتقالي في القسامة ، والذي سيتم معايرته بحمض. عندما يتم الوصول إلى نقطة التكافؤ ، يتحول لون المؤشر إلى اللون الأصفر.
2.- الفينول فثالين: يكون شفافًا في البداية في القسمة ، والتي ستتم تسميتها بقاعدة. عندما يتم الوصول إلى نقطة التكافؤ ، يتحول المؤشر إلى اللون الوردي.
3.- أسود إريكروم: هو المؤشر المستخدم لتحديد درجة عسر الماء. في البداية يكون لونه أرجوانيًا في القسامة ، حتى تتم معايرته بعامل معقد. في نهاية التفاعل ، يتحول إلى اللون الأزرق.

أدوات في التحليل الحجمي
في التحليل الحجمي ، سيتم استخدام سلسلة من الأدوات التي ، إذا لم تكن متوفرة ، لا يمكن تطويرها بشكل كافٍ:
1.- الدورق الحجمي: وهو عبارة عن وعاء يشبه المصباح في جزئه السفلي ، مفلطح من الأسفل ، وفيه عمود رفيع يضاف إليه السائل. يحتوي على علامة تشير إلى المكان الذي يجب أن يكون فيه الغضروف المفصلي للسائل ، بحيث يغطي الحجم الدقيق. يتم استخدامه لاحتواء الحلول القياسية ؛ بفضل دقة حجمه ، يتم ضمان تركيز معروف.

2.- الماصات: وهي عبارة عن أنابيب رفيعة متدرجة تسمح بقياس كميات السائل بدقة وموثوقة. وهي متوفرة حتى 25 مليلترًا ، وتسمح بأخذ عينات دقيقة.
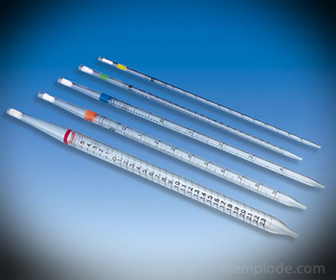
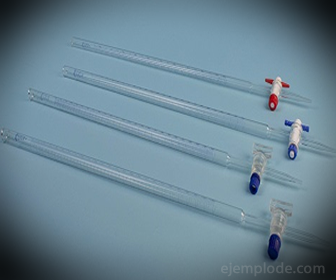
3.- Burette: عبارة عن أنبوب ممدود بسعة 50 ملليلترًا يحتوي على المحلول القياسي. يوجد في أحد طرفيه صمام تنظيم التدفق الذي سيقوم بتصريف المحلول في القسامة.
4- قوارير إرلنماير Erlenmeyer flats: وهي أوعية ذات قاعدة مسطحة ومخروطية الشكل تنتهي بحافة أسطوانية. هذا التصميم يجعلها مناسبة للمعايرة الكيميائية ، لأنها لا تسمح باهتزاز المحاليل لتجاوزها. ستكون هناك حاجة إلى ما لا يقل عن ثلاثة في حالة إجراء اختبار متكرر ، لضمان نتيجة موثوقة.

الحسابات في التحليل الحجمي
عند التعامل مع المحاليل المائية ، فإن الكميات المهمة للتحليل الحجمي هي التركيز والحجم.
تعتمد المعادلة الرئيسية لقياس الحجم على أربع بيانات رئيسية:
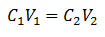
ج1= تركيز العينة (غير معروف)
الخامس1= حجم القسامة التي تم عمل التحليل بها
ج2= تركيز الحل القياسي المستخدم للوصول إلى نقطة التكافؤ
الخامس2= الحجم القياسي للحل المطلوب للوصول إلى نهاية التفاعل
يتم استبدال البيانات في المعادلة ، ولم يتبق سوى التركيز المطلوب غير المعروف. بالطبع ، يجب أن تكون جميع البيانات على نفس محركات الأقراص.
أمثلة على التحليل الحجمي
تقدير الكلوريدات (Cl-) بواسطة Argentometry ، مع نترات الفضة.
تقدير البروميدات (Br-) بواسطة Argentometry ، مع نترات الفضة.
تقدير السيانيد (CN-) بواسطة Argentometry ، مع نترات الفضة.
تقدير كربونات المغنيسيوم (MgCO3) ، عن طريق كومبلكسومتري ، مع EDTA.
تقدير كربونات الكالسيوم (CaCO3) ، عن طريق كومبلكسومتري ، مع EDTA.
تحليل حامض الكبريتيك (H2جنوب غرب4) مع هيدروكسيد الصوديوم (NaOH).
تحليل هيدروكسيد الصوديوم (NaOH) مع حمض الهيدروكلوريك (HCl).
تقدير الأنتيمون (III) مع برمنجنات البوتاسيوم (KMnO4).
تقدير الزرنيخ (III) مع برمنجنات البوتاسيوم (KMnO4).
تقدير تيتانيوم (III) مع برمنجنات البوتاسيوم (KMnO4).
تقدير الموليبدينوم (III) مع برمنجنات البوتاسيوم (KMnO4).
تقدير نسبة الحديد (II) مع برمنجنات البوتاسيوم (KMnO4).
تحديد أيون الأكسالات مع برمنجنات البوتاسيوم (KMnO4).



