مثال الرابطة التساهمية
كيمياء / / July 04, 2021
ال الرابطة التساهمية هو الذي فيه تتحد ذرتان من خلال مشاركة إلكتروناتهما، لإكمال قواعد الثمانية الخاصة بك.
تاريخ الرابطة التساهمية
في أوائل القرن العشرين بدأ الكيميائيون في فهم كيف ولماذا تشكلت الجزيئات. جاء الاختراق الرئيسي الأول مع اقتراح جيلبرت لويس من ماذا تشكيل رابطة كيميائية يعني ذلك تشترك الذرات في الإلكترونات. وصف لويس تكوين رابطة كيميائية في الهيدروجين على النحو التالي:
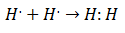
هذا النوع من اقتران الإلكترون هو مثال على الرابطة التساهمية ، وهي الرابطة التي يتم مشاركة إلكترونين بواسطة ذرتين. ال المركبات التساهمية هم ذلك تحتوي فقط على روابط تساهمية.
الإلكترونات في الرابطة التساهمية
من أجل البساطة ، فإن ملف زوج إلكترون مشترك غالبًا ما يتم تمثيله كـ سطر واحد ربط رموز العناصر. وهكذا ، فإن الرابطة التساهمية لجزيء الهيدروجين مكتوبة كـ H-H.
في الرابطة التساهمية ، كل إلكترون من الزوج المشترك ينجذب إلى نوى كلتا الذرتين. هذا التجاذب يحمل الذرتين في جزيء H معًا.2 وهي مسؤولة عن تكوين الروابط التساهمية في الجزيئات الأخرى.
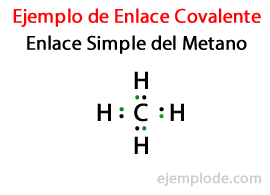
في الروابط التساهمية بين ذرات عدة إلكترونات فقط إلكترونات التكافؤ تشارك، التي هي الأبعد ، في المدار الضحل. وسيشارك ما بين واحد وثلاثة منهم في الاتحاد.
تسمى الإلكترونات الأخرى التي لا تشارك في الرابطة الإلكترونات غير الرابطة، أو إذا نظمناها في أزواج ، أزواج مجانية. وهذا هو ، أزواج فالنسيا إلكترونات ذلك لا تشارك في تكوين الرابطة التساهمية.
تمثيل الرابطة التساهمية
الهياكل التي يتم تمثيل المركبات التساهمية بها ، مثل H2 و F2 معروفة باسم هياكل لويس. هيكل لويس هو أ تمثيل الرابطة التساهميةحيث يتشارك زوج الإلكترونات يشار إليها بخطوط أو أزواج من النقاط بين ذرتين، والأزواج الحرة غير المشتركة يشار إليها كأزواج من النقاط على الذرات الفردية. في بنية لويس ، يتم عرض إلكترونات التكافؤ فقط ، وليس الإلكترونات الداخلية.
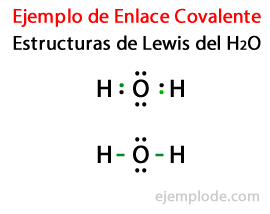
النظر في بنية لويس لجزيء الماء H2أو يتم تمييز جميع إلكترونات التكافؤ في ذرات الهيدروجين والأكسجين أولاً بالنقاط.
في الحالة الثانية ، يتم تمييز الارتباط بخط. والأزواج الحرة ، التي ستتواجد فقط في الأكسجين ، مع نقاط.
حكم الثمانية
تكوين هذه الجزيئات ، مثل جزيئات الماء H.2أو قم بتوضيح المكالمة القاعدة الثماني، مقترح من قبل لويس: تميل ذرة أخرى غير الهيدروجين إلى تكوين روابط حتى تحيط نفسها بها ثمانية إلكترونات تكافؤأي أن الرابطة التساهمية تتشكل عندما لا يكون هناك ما يكفي من الإلكترونات لكل ذرة لإكمال ثماني بتاتها.
من خلال مشاركة الإلكترونات في رابطة تساهمية ، كل ذرة تكمل ثماني بتاتها. بالنسبة للهيدروجين ، فإن الشرط هو أن تحصل على التكوين الإلكتروني للهيليوم ، وهو الحصول على إجمالي إلكترونين.
تعمل قاعدة الثمانيات بشكل أساسي لعناصر الفترة الثانية أو صف الجدول الدوري. تحتوي هذه العناصر على مستويات فرعية يمكن أن يكون فيها إجمالي ثمانية إلكترونات.
عندما تشكل ذرة من هذه العناصر مركبًا تساهميًا ، فإنها تحصل على التكوين الإلكتروني لغاز النيون النبيل ، وتتشارك الإلكترونات مع ذرات أخرى في نفس المركب.
أنواع الروابط التساهمية
يمكن أن تشكل الذرات أنواعًا مختلفة من الروابط التساهمية: الفردي ، الزوجي أو الثلاثي.
في رابط بسيط، يتم ربط ذرتين عن طريق زوج من الإلكترونات. تحدث في الغالبية العظمى من المركبات التساهمية ، وهي الشكل الأساسي لهذه الرابطة.
في العديد من المجمعات ، روابط مزدوجة، أي عندما تشترك ذرتان زوجان من الإلكترونات. إذا كانت ذرتان تشتركان في زوجين من الإلكترونات ، فإن الرابطة التساهمية تسمى الرابطة المزدوجة. تم العثور على هذه الروابط في جزيئات مثل ثاني أكسيد الكربون (CO2) والإيثيلين (C2ح4).

أ رابط ثلاثي ينشأ عندما تشترك ذرتان ثلاثة أزواج من الإلكترونات، كما في جزيء النيتروجين N2، جزيء الأسيتيلين سي2ح2.

الروابط المتعددة أقصر من الروابط التساهمية المفردة. ال طول الارتباط يتم تعريفه على أنه المسافة بين نواة ذرتين متصلتين بواسطة رابطة تساهمية في جزيء.
الاختلافات بين المركبات التساهمية والأيونية
تظهر المركبات الأيونية والتساهمية اختلافات ملحوظة في خواصها الفيزيائية العامة ، بسبب حقيقة أن روابطها ذات طبيعة مختلفة.
في ال المركبات التساهمية يخرج نوعان من القوى الجاذبة; واحد منهم هو الذي يجمع ذرات الجزيء معًا. المقياس الكمي لهذا الجذب هو طاقة الربط. تعمل قوة الجذب الأخرى بين الجزيئات الكاملة ، وتسمى قوة الجزيئات. نظرًا لأن القوى بين الجزيئات عادة ما تكون أضعف من القوى التي تمسك ذرات الجزيء معًا ، فإن جزيئات الرابطة التساهمية المركبة تكون أقل قوة.
في تكريس ، تكون المركبات التساهمية دائمًا عبارة عن غازات أو سوائل أو مواد صلبة منخفضة الانصهارن. من ناحية أخرى ، القوى الكهروستاتيكية التي تربط الأيونات معًا في المركب الأيوني عادة ما تكون قوية جدًا، بحيث تكون المركبات الأيونية صلبة في درجة حرارة الغرفة ولها نقاط انصهار عالية. العديد من المركبات الأيونية قابلة للذوبان في الماء ، ومحاليلها المائية توصل الكهرباء لأن هذه المركبات عبارة عن إلكتروليتات قوية.
أكثر من المركبات التساهمية غير قابلة للذوبان في الماء، وإذا تم حلها ، محاليلها المائية كل عادة لا يوصلون الكهرباء لأن هذه المركبات غير إلكتروليتات. تقوم المركبات الأيونية المنصهرة بتوصيل الكهرباء لاحتوائها على الكاتيونات والأنيونات التي تتحرك بحرية. المركبات التساهمية السائلة أو المنصهرة لا توصل الكهرباء لعدم وجود أيونات.
أمثلة على المركبات المرتبطة تساهميًا
- الأسيتيلين ج2ح2
- الميثان CH4
- الإيثان سي2ح6
- البروبان سي3ح8
- البيوتان سي4ح10
- بنزين ج6ح6
- تولوين سي7ح8
- كحول الميثيل CH3أوه
- كحول الإيثيل ج2ح5أوه
- كحول البروبيل ج3ح7أوه
- ميثيل الأثير CH3OCH3
- ميثيل إيثيل إيثر سي2ح5OCH3
- إيثيل إيثر سي2ح5OC2ح5
- حمض الفورميك HCOOH
- حمض الخليك CH3COOH
- حمض البروبيونيك ج2ح5COOH
- حمض الزبد ج3ح7COOH
- ثاني أكسيد الكربون CO2
- أول أكسيد الكربون CO
- النيتروجين الجزيئي N2
- الهيدروجين الجزيئي H2



