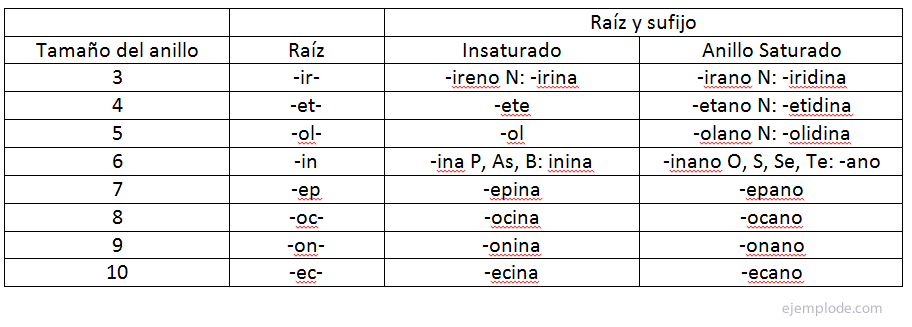
Определение на хомогенно и хетерогенно равновесие
Miscellanea / / December 12, 2021
Концептуална дефиниция
Равновесието на химическата реакция може да бъде хомогенно, ако всички реагенти и продукти са в едно и също агрегатно състояние или хетерогенно, ако участват различни продукти и реагенти фази.

Инженер-химик
Хомогенни равновесия
Като цяло киселинно-алкалните равновесия са хомогенни, тъй като се срещат във водни разтвори. По същия начин, степента на йонизация на всяка киселина или основа ще доведе до рН на решение и този процес се управлява от константата на киселинност или основност, известна като Ka и Kb съответно.
Ето един пример за Баланс хомогенен химикал и съответната му константа на равновесие:

да бъдеш:

Трябва да се помни, че химичното равновесие възниква, когато скорост на реакция преки равни скорост непряка реакция.
Хетерогенни равновесия
Като цяло, ние ги приписваме на разтвори или утаяване на йонни съединения, тъй като тяхната начална или крайна фаза реагира на твърдо вещество, което се разрежда или утаява във воден разтвор. Трябва да се отбележи, че в тези случаи константата, която управлява процеса, е равновесната константа Keq, но твърдите тела не влизат в игра в продуктите на тази константа.
Ясен пример за хетерогенно равновесие е разлагането при високо температура от твърд калциев карбонат, образуващ твърд калциев оксид и газообразен въглероден диоксид:

да бъдеш:

Хетерогенни равновесия твърдо-течност
При хетерогенни равновесия, при които твърдо вещество се утаява, константата на продукта на разтворимост или Kps играе основна роля и е това, в този случай, равновесната константа, която управлява процеса, показваща колко разтворимо е твърдото вещество в използвания разтворител, обикновено Вода.
За какво се отнася? На практика до образуването на неразтворим или слабо разтворим продукт от йонно съединение, следователно в тези случаи има поредица от фактори Те играят важна роля.
На първо място, както при всяко равновесие, температурата, тъй като повишаването на температурата води до увеличаване на Кинетична енергия на кристалите, което отслабва силите на свързване поради причинените вибрации.
От друга страна, естеството на взаимодействащите съединения, тъй като, както знаем, толкова по-голямо приликата в полярността на разтворителя и съединението, което трябва да се разтвори, толкова по-добра е степента на разтворимост. Това се обяснява, тъй като величината на силите на взаимодействие между разтворителя и твърдото вещество, което трябва да се разтвори, трябва да бъде подобна на тези, които твърдото вещество е притежавало първоначално.
И накрая, ентропията на системата играе много важна роля. Вариацията на ентропията обяснява степента на подреденост на системата и, както е известно, Вселената винаги клони към хаос или безпорядък. Когато се случи разтварянето, връзките на йонното съединение се разрушават, което увеличава разстройството, следователно процесът е широко предпочитан.
Така че, когато йонно съединение се разтваря в прекия смисъл на равновесната реакция и се утаява, в обратния смисъл, отношението, което управлява процеса, е константата на споменатия продукт на разтворимост.
И в двата вида равновесия можем да подчертаем общи характеристики: първо, температурата играе основна роля, тъй като контролира равновесието. Ако тази променлива варира, съгласно принципа на Льо Шателие системата ще реагира по такъв начин, че да противодейства на споменатото смущение. По същия начин стойността на равновесната константа е уникална за всяка равновесна реакция при дадена температура и съответства на коефициент от дейности, така че е независим от концентрацията или налягането на продуктите и реагенти. За да се задълбочи изследването на вариацията на Keq с температурата, е необходимо да се задълбочим в уравнение от Van’t Hoff.
Второ, състоянието на равновесие не трябва да се променя във времето и когато говорим за състояние на равновесие, имаме предвид процес, който се осъществява в затворена система.
От друга страна, във всички случаи, на изразяване на равновесните константи, какъвто и да е извършен процесът, запазва формата си като: концентрация на продукти повишени до съответните им стехиометрични коефициенти по отношение на концентрацията на реагента, повишени до техните коефициенти стехиометричен. Трябва да се отбележи, че повечето от тези константи са представени в таблица при 25ºC.
Библиография
Бележки на председателя, Обща химия I, UNMdP, Инженерен факултет, 2019 г.
Теми за хомогенно и хетерогенно равновесие