Примери за ендотермични реакции
Примери / / November 09, 2023
А ендотермична реакция Това е реакция, която абсорбира енергия от средата под формата на топлина. При тези реакции, за да се трансформират реагентите в продукти, е необходимо те да абсорбират топлина, което кара продуктите да имат по-голяма енергия от реагентите, които са ги породили. Някои примери за ендотермични реакции са: фотосинтеза и електролиза на вода.
- Вижте също: Химична реакция
Примери за ендотермични реакции в ежедневието
Някои от основните ендотермични реакции са:
Производство на озон в атмосферата. Озонът се произвежда в атмосферата, когато молекулярният кислород (O2) абсорбира ултравиолетовото лъчение и се разгражда. Тогава кислороден атом (O) може да взаимодейства с друга кислородна молекула (O2) и образуват озон (O3).

Водна електролиза. Това е процесът, чрез който се прилага електрическа енергия към водата, за да я раздели на двата й компонента, водород (H) и кислород (O).
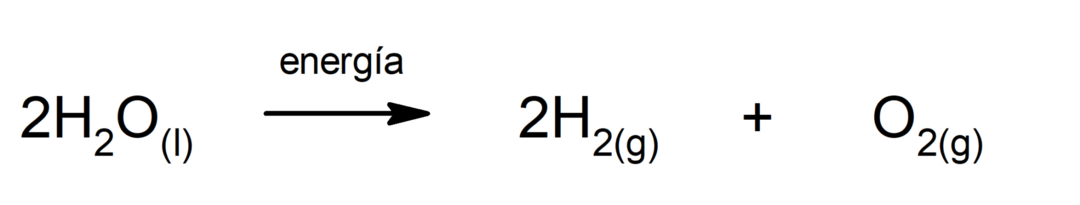
фотосинтеза. Това е химичната реакция, чрез която абсорбирането слънчева енергия, въглероден диоксид (CO2) се трансформира в глюкоза. Тази реакция представлява основният начин на хранене на растенията.
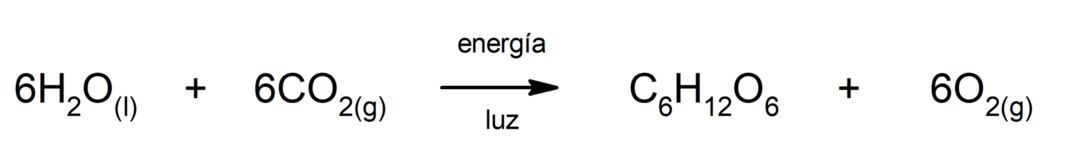
Производство на железен (II) сулфид. За да се осъществи реакцията между сярата и желязото, е необходимо да се осигури енергия под формата на топлина.
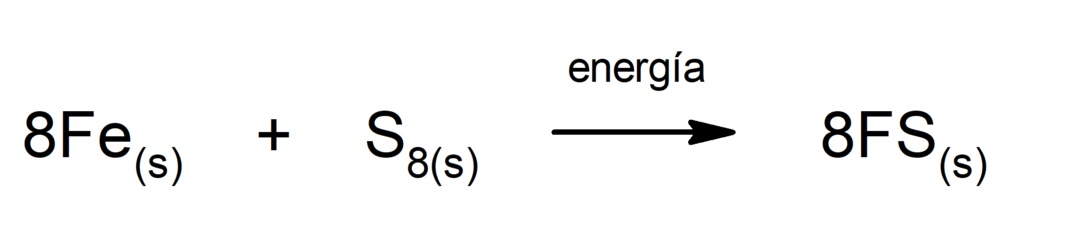
Разлагане на въглероден диоксид (CO2). Разграждането на CO2 При високи температури той произвежда въглероден окис (CO) и кислород (O2).
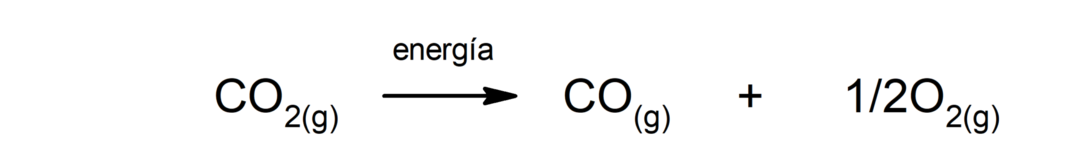
Разлагане на калциев карбонат (CaCO3). Калциевият карбонат се разлага с абсорбиране на топлина, за да се получи калциев оксид (CaO) и въглероден диоксид (CO2).
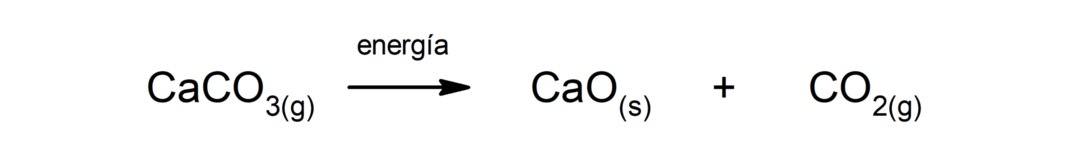
Разлика между ендотермична и екзотермична реакция
Основната разлика между ендотермичните и екзотермичните реакции е, че ендотермичните реакции абсорбират топлина, докато екзотермичните реакции отделят топлина.
Освен това ендотермичните реакции се характеризират с увеличаване на енталпията, докато екзотермичните реакции са свързани с намаляване на енталпията.
Енталпията е термодинамична величина, която определя потока на топлинна енергия при постоянно налягане по време на химическа реакция. Представя се с буквата H, а нейната вариация е един от основните показатели за определяне дали дадена химична реакция е ендотермична или екзотермична.
- Ако химическа реакция има промяна на енталпията, по-голяма от нула (ΔH > 0) е ендотермичен.
- Ако една химическа реакция има промяна на енталпията, по-малка от нула (ΔH < 0) е екзотермична.
Следвайте с:
- Физикохимични явления
- Химията в ежедневието
- Химията в ежедневието
- Органична и неорганична химия
Препратки
- Сото-Кордоба, С. (2016). Ендотермични реакции. Техническо хранилище Технологичен институт на Коста Рика.
- Короминас, Дж. (2017). Химични реакции в ежедневието. Алембик, (90), 8-26.
- Санчес, М. T. М. и Санчес, М. М. (2002). Експериментално изследване на ендотермични реакции за студенти от ESO. Анали по химия на RSEQ, (4), 36-39.


