Пример за закона на Чарлз
Физика / / July 04, 2021
Законът за газа на Чарлз или Законът за постоянното налягане е друг от газовите закони, изречен от Гей-Лусак, който пусна творбата на Жак Шарл, публикувана около 20 години преди това.
Законът на Чарлз предсказва поведението на маса газ, когато налягането остава постоянно и температурата и обемът варират.
Законът на Чарлз се посочва, както следва:
При постоянно налягане обемът на даден газ е право пропорционален на промяната в неговата температура.
Постоянен натиск: се отнася до факта, че налягането, което газът упражнява върху стените на контейнера, няма да варира през целия опит.
Сила на звука: това е заетото пространство, което газът заема, като цяло се счита за контейнер със стени, които не се деформират и чийто капак работи като бутало.
Температура: Това е увеличаването или загубата на топлина, които газът претърпява по време на експеримента. Ако температурата се увеличи, обемът се увеличава. Ако температурата намалее, обемът също намалява.
Алгебрично законът на Чарлз се изразява със следната формула:

Където:
V = обем на газа
T = температура на газа
k = константа на пропорционалност за тази маса газ.
Това означава, че за дадена маса газ, при постоянно налягане, връзката между обема и температурни вариации, винаги ще имат една и съща пропорционалност, представена от константата k:

Така че след като константата бъде определена, можем да изчислим някоя от другите стойности от другите известни данни:
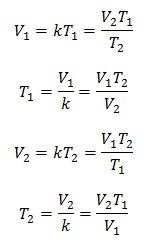
3 Примери на закона на Чарлз, приложим към проблемите:
Пример 1: Изчислете новия обем, ако в контейнер има маса газ, която заема обем от 1,3 литра, при температура 280 К. Изчислете обема при достигане на температура от 303 К.
V1 = 1,3 л.
T1 = 280 K
V2 = ?
T2 = 303 К
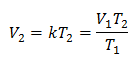
Заместване на стойности:
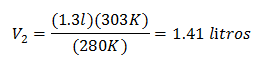
Новият обем при 303 К е 1,41 литра.
Пример 2. Ако имаме газ, който заема 2,4 литра при 10 градуса по Целзий, изчислете крайната температура, ако в края тя заема 2,15 литра.
V1 = 2,4 л
T1 = 10 ° С = 283 К.
V2 = 2,15 л
T2 = ?
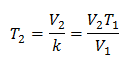
Заместване на стойности:
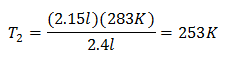
Новата температура е 253 K, което е равно на -20 ° C.
Пример 3. Имаме газ, чиято начална температура е 328 K, крайният му обем е 3,75 l, а константата му е 0,00885.
V1 = ?
T1 = 328 К
V2 = 3,75 л
T2 = ?
k = 0,00885
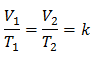
Заместване на стойности:
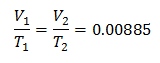
За да знаете първоначалния обем:
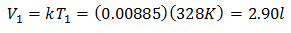
Първоначалният обем е 2,90 л.
За да знаете крайната температура:
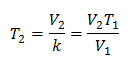
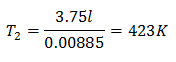
Крайната температура ще бъде 423 K, което е равно на 150 ° C.


