50 Příklady řešení
Různé / / July 04, 2021
The řešení jsou jedním z typů směsi které existují. Složky, které tvoří roztok, nereagují chemicky, i když fyzikální vlastnosti těchto složek lze upravit, když se stanou součástí roztoku. Například: kouř, amalgám, káva s mlékem.
Aby směs byla řešením, musí být homogenní Y jednotný, to znamená, že smíšené složky nelze rozeznat pouhým okem a navíc poměr mezi rozpuštěnou látkou (látkou, která se objevuje v menším množství) a solventní (látka, která se objeví ve větším množství) zůstává přibližně beze změny v jakémkoli objemu odebraném z roztoku. Podíl rozpuštěné látky v roztoku nebo v rozpouštědle se označuje jako „koncentrace“ a obvykle lze stejný roztok připravit za použití různých koncentrací rozpuštěné látky.
Mohou se tvořit roztoky mezi látkami, které jsou před smícháním obsaženy v jakékoli z těchto látek stavy agregace. Řešení existují prakticky ve všech stavech agregace. Obecně je stav agregace roztoku určen stavem agregace rozpouštědla. Například:
Je to běžné pro přítomnost molekul rozpuštěné látky v rozpouštědle mění vlastnosti samotného rozpouštědla. Například teploty tání a teploty varu dvou sloučenin se mění, když jsou tyto sloučeniny smíchány, stejně jako jejich složení.
hustoty a barvy.Francouzský vědec Roult studoval toto chování komponent v řešeních a také navrhl jeho hlavní zákon (Roultův zákon), který uvádí, že parciální tlak par každé složky ve směsi par obklopující ideální řešení z kapaliny rovná se parciálnímu tlaku každé čisté složky a její molové frakci v roztoku. Za ideální řešení se považuje takové řešení, ve kterém jsou chemické látky velmi podobné, takže se neuvažuje o žádné změně energie interakcí mezi nimi. Základní rovnice Roultova zákona je:
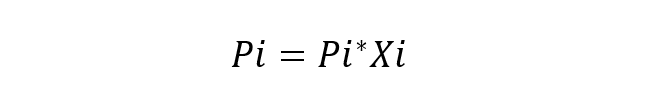
Kde:
- Pi je parciální tlak součásti i v plynné směsi obklopující roztok.
- Pi * je tlak součásti i
- Xi je molární zlomek složky i v rozpuštění.
Je zřejmé, že lidé jsou trvale v kontaktu s řešeními. The vzduch je rozpuštění prvků v plynný stav: jeho většinové složení je dáno dusík (78%) a zbytek je obsazen 21% kyslík a 1% dalších složek, i když se tyto poměry mohou mírně lišit.
Příklady řešení
Následující seznam obsahuje čtyřicet příkladů řešení, které zvýrazňují stav agregace, ve kterém se každý z nich nachází, rozpuštěnou látku v příslušném rozpouštědle.
- Vzduch (plyn v plynu). Složení plynů, kde je dusík nejhojnější.
- Kouř (pevná látka v plynu). Vzduch je zatuchlý vzhledem k kouři z ohně. Jedná se o řešení, ve kterém vzduch působí jako rozpouštědlo.
- Slitiny mezi kovy (pevná látka v pevné látce). Dural je slitina vyrobená z hliníku, mědi, manganu, hořčíku a křemíku.
- Atmosférický vzduchový prach (pevná látka v plynu). Přítomnost pevných látek (rozložených téměř na nedělitelnou jednotku, ale nakonec pevné látky) v plynu je příkladem rozpouštění v tomto smyslu.
- Ocel (pevná látka v pevné látce). Slitina mezi železem a uhlíkem, s mnohem vyšším podílem uhlíku.
- Sycené nápoje (plyn v kapalině). Sycené nápoje mají rozpouštění plynů v kapalině.
- Amalgám (kapalina v pevné látce). Jsou to slitiny rtuti rozpuštěné v určitých kovy jako zlato nebo stříbro.
- Rafinovaná ropa (kapalina v kapalině). Kombinace prvků, které jej tvoří (většinou uhlík), vede k rozpuštění mezi kapalinami.
- Butan ve vzduchu (plyn v plynu). Butan je chemická sloučenina plynné, které lze skladovat v tubách, připravené k použití jako palivo.
- Kyslík ve vodě oceánu (plyn v kapalině). Okysličení mořské vody umožňuje rozvoj vodního života.
- Nápoje s obsahem alkoholu (kapalina v kapalině). Lidé je při oslavách velmi konzumují. Obvykle se jedná o roztoky ethanolu a ovocných šťáv v kontrolovaných koncentracích alkoholu alkohol.
- Káva s mlékem (kapalina v kapalině). Kapalina s vyšším obsahem dostává trochu od jiné, což představuje transformaci její barvy a chuti.
- Smog (plyny na plyny). Zavádění plynů, které nejsou typické pro atmosféru, vyvolává transformaci vzduchu, který má negativní dopady na společnosti, které jí dýchají: čím koncentrovanější, tím škodlivější to bude.
- Sůl ve vodě (pevná látka v kapalině). Široce se používá k vaření.
- Krev (kapalina v kapalině). Hlavní složkou je plazma (kapalina) a v ní se objevují další prvky, mezi nimiž vynikají červené krvinky.
- Amoniak ve vodě (kapalina v kapalině). Toto řešení (které lze také vyrobit z plynu na kapalinu) je funkční pro mnoho čisticích prostředků.
- Vzduch se stopami vlhkosti (kapalina v plynu). Vodní pára je přítomna ve vzduchu kvůli zvýšené teplota.
- Práškové šťávy (pevná látka v kapalině). Prášek se rozpouští ve vodě a vytváří roztok barvy práškové šťávy.
- Vodík v palladiu (plyn v pevné látce). Vodík se v některých kovech velmi dobře rozpouští.
- Vzdušné viry (pevná látka v plynu). Stejně jako atmosférický prach jsou to velmi malé jednotky pevné látky, které jsou transportovány plynem.
- Rtuť ve stříbře (kapalina v pevné látce). Je to jeden z takzvaných „amalgámů“.
- Čaj (pevná látka v kapalině). Pevná látka ve velmi malých rozměrech (žula obálky) se rozpouští na vodě.
- Královská voda (kapalina v kapalině). Je to složení kyseliny což umožňuje rozpuštění různých kovů, mezi nimiž se objevuje zlato.
- Bronz (pevná látka v pevné látce). Je to slitina mezi mědí a cínem.
- Limonáda (kapalina v kapalině. Ačkoli je směs mnohokrát mezi pevnou látkou a kapalinou, ve skutečnosti jde o kapalinu přítomnou v této pevné látce, jako je citronová šťáva.
- Peroxid (kapalina v kapalině). Je to roztok peroxidu vodíku (H2NEBO2) ve vodě. Používá se k dezinfekci ran a v kosmetickém průmyslu.
- Mosaz (pevná látka v pevné látce). Je to slitina mezi pevnou mědí a zinkem.
- Chlazení ledem (pevná látka v kapalině). Led vstupuje do kapaliny a během rozpouštění ji ochlazuje. Pokud je přidán do vody, jedná se o konkrétní případ, kdy jde o stejnou látku.
- Fyziologické řešení (kapalina v kapalině). Voda působí jako rozpouštědlo a mnoho kapalných látek působí jako rozpuštěná látka.
- Koktejly (pevné látky v kapalinách). Procesem mletí je vyvolána kombinace pevných látek s kapalinami.
Postupujte podle:



