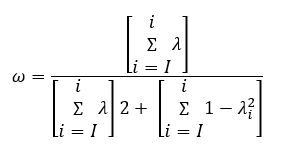20 Příklady chemických reakcí
Různé / / July 04, 2021
To se nazývá chemická reakce k procesu, kterým jeden nebo více chemické substance (nazývané „reaktanty“) se transformují a vytvářejí další (nazývané „produkty“). Pro reaktanty tedy ke generování produktů chemickou reakcí dochází k přeskupení atomy Y molekuly ve kterém dochází k výměně energie. Například: spalování, oxidace, acidobazické reakce.
The chemické sloučeniny mít chemická energie ve vazbách mezi atomy, které je tvoří. Chemické reakce se obvykle vyjadřují pomocí rovnic, kde jsou reaktanty označeny vlevo a produkty vpravo, propojení obou částí šipkou doprava, pokud je reakce reverzibilní, nebo šipkou tam a zpět, pokud se jedná o reakci reverzibilní.
Když jsou uvedena množství nebo podíly, ve kterých reagují reaktanty a jsou získány produkty, hovoříme o stechiometrických reakcích.

Kde:
- A a B jsou reaktanty.
- C a D jsou produkty.
- a, b, c, d jsou stechiometrické koeficienty (počet molekul nebo atomů určitého typu, které se účastní chemické rovnice).
Chemické reakce lze klasifikovat podle typu energie, kterou uvolňují nebo absorbují. V tomto smyslu mohou být exotermické nebo endotermické (pokud se uvolňují nebo absorbují
horký), exoluminous nebo endoluminous (pokud uvolňují nebo absorbují světlo), exoelektrické nebo endoelektrické (pokud vyrábějí nebo potřebují elektřina).Zákony chemických reakcí
Při chemických reakcích jsou zákony splněny. Nejdůležitější je zákon zachování hmoty nebo zákon z Lavoisier, formulovaný tímto chemikem v roce 1774, který předpokládá, že při každé chemické reakci je hmotnost reaktantů rovna hmotnosti produktů.
to bylo Dalton který dokončil vysvětlení tohoto zákona o několik let později tím, že naznačil, že v chemické reakci je počet atomy se při srovnání reaktantů s produkty nemění, mění se pouze jejich organizace, takže hmotnost se konzervuje.
Dalším důležitým parametrem v chemických reakcích je jejich rychlost reakce protože ne všem trvá výroba stejného času. Reakční rychlost je definována jako množství produktu, které se objeví za jednotku času, nebo množství činidla, které zmizí za jednotku času.
I když má každá reakce jinou rychlost, určité faktory mohou způsobit její tendenci ke zvýšení nebo pokles: kontaktní povrch mezi reagujícími částicemi a teplotou jsou některé z ony.
The katalyzátory Jsou to látky, které zvyšují rychlost reakce, aniž by upravovaly její strukturu. Někteří tuto roli často plní kovy.
Příklady chemických reakcí
Chemické reakce probíhají nepřetržitě v přírodě, v lidském těle, v továrnách, v čistírnách odpadních vod atd. Některé příklady jsou:
-
Spalování

-
Střídání

-
Přidání

-
Odstranění

-
Oxidace

-
Snížení

-
Acidobazické reakce

-
Okysličování

-
Transaminace

-
Chlorace

-
Karbonylace

-
Nitrosilace. Jedná se o reakci, při které je nitrosylová skupina navázána na protein poté, co byl syntetizován ribozomy.

-
Peroxidace

-
Fotolýza vody

-
Sulfatace

-
Karbonatace

- Ozonace. Jde o alternativní reakci na chloraci k dekontaminaci vody.
-
Esterifikace

-
Hydrogenace alkenů

-
Acetylace