Co je to elektrolýza
Chemie / / July 04, 2021
V chemii Elektrolýza je fenomén, ve kterém elektrický proud prochází vodným roztokem iontové sloučeninya začíná nasměrujte ionty (nabité částice) sloučeniny a dvě elektrody, pozitivní (Anoda, přitahuje záporně nabité anionty) a záporné (Katoda, přitahuje kladně nabité kationty). Tento jev se řídí zákonem elektrostatiky, který naznačuje, že opačné náboje se navzájem přitahují.
Elektrolyty
V roce 1883 Michael Faraday objevil, že vodné roztoky určitých látek vedou elektrický proud, zatímco roztoky jiných látek ne.
Aby otestoval, zda vodný roztok vede elektrický proud, navrhl Faraday jednoduché zařízení sestávající z a Obvod 110 V DC, lampa, Y připojeny dvě kovové nebo grafitové elektrody k aktuálnímu zdroji.
Pokud jsou elektrody ponořeny do vody, je proud protékající tak malý, že lampa nesvítí; totéž platí, pokud jsou ponořeny do roztoku cukru.
Naopak, pokud jsou ponořeni do řešení Chlorid sodný NaCl nebo z Kyselina chlorovodíková HCl, lampa jasně září, což dokazuje, že rozpouštění je vynikající vodič
. Na druhou stranu pomocí Acetic Acid CH3Koncentrovaný COOH, roztok vede proud špatně, ale když se kyselina zředí vodou H2Nebo se zvyšuje jeho elektrická vodivost.Během průchodu proudu různými řešeními se na elektrodách získávají různé produkty.
V průběhu studia elektrolýzy vyvodil Faraday následující zákony:
1. zákon: Množství látky, která má chemickou transformaci v elektrodě, je úměrné množství elektřiny, které prochází roztokem.
2. zákon: Pokud stejným množstvím elektřiny prochází různá řešení, hmotnosti látek rozložené nebo uložené na různých elektrodách jsou úměrné ekvivalentní hmotnosti uvedených látky.
Uvedeme příklad:
Předpokládá se, že máte pět různých elektrolytických článků. První s Kyselina chlorovodíková HCl, druhý s Síran měďnatý CuSO4, třetí s Antimonious Chloride SbCl3, čtvrtý s Chlorid cínatý SnCl2 a pátý s Chlorid cíničitý SnCl4.
Stejný proud prochází řadou elektrolytických článků až do 1 008 gramů vodíku (a Ekvivalentní hmotnost vodíku) roztoku kyseliny chlorovodíkové, hmotnosti (v gramech) ostatních produktů uvolněných ve stejnou dobu Oni jsou:
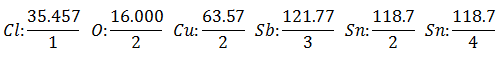
The Ekvivalentní hmotnost má hodnotu Atomová hmotnost prvku dělená Valencí prvku.
K uvolnění ekvivalentní hmotnosti jakékoli položky potřebujete 96500 Coulombs. Toto množství elektřiny se nazývá 1 Faraday.
Faradayova jednotka
Ampér je definován jako rovnoměrný proud, který ukládá 0,001118 gramů stříbra (Ag) z roztoku dusičnanu stříbrného (AgNO3) za sekundu. Protože atomová hmotnost stříbra je 107,88 g / mol, poměr 107,88 / 0,001118 dává počet ampérsekund nebo Coulombs potřebná elektřina uložit chemický ekvivalent stříbra. Toto množství je 96494 Coulombs (hodnota 96500 je pro přibližné výpočty poměrně přibližná) a nazývá se 1 Faraday elektřiny.
Elektrody
Zavolal Faraday Anoda na pozitivní elektrodu a katoda na negativní elektrodu. Vytvořil také výrazy Anion a Cation, aplikované na látky, které se během elektrolýzy objevují na anodě a na katodě.
V současné době je další definice pro elektrody:
Anoda: Elektroda, ve které dochází ke ztrátě elektronů nebo oxidaci.
Katoda: Elektroda, ve které je elektronový zisk nebo redukce.
Elektrolyty a neelektrolyty
Vedení elektrického proudu řešeními nebylo uspokojivě vysvětleno až do roku 1887, kdy Svante Arrhenius oznámil svou teorii. Před oceněním a pochopením Arrheniovy teorie jsme nejprve uvedli některá fakta, která věda věděla, když ji Arrhenius formuloval:
The Neelektrolytová řešení mají vlastnosti, které lze vypočítat použitím Raoultova zákona. Tlak par a pozorované teploty varu a tuhnutí těchto roztoků jsou prakticky stejné jako vypočtené hodnoty.
The Raoultův zákon vysvětluje, že tlak par každé rozpuštěné látky v roztoku závisí na jeho vlastní molové frakci v něm, vynásobené jeho tlakem par v čistém stavu.

Raoultův zákon selhal při aplikaci na roztoky elektrolytů ve vodě. Variace tlaku par a bodů varu a mrazu jsou vždy větší než ty, které předpovídá výše uvedený zákon, a dále se zvyšují při ředění.
Tyto odchylky jsou reprezentovány hodnotou i, což je poměr variace pozorované v bodě tuhnutí mezi změnou vypočtenou v bodě tuhnutí:

Hodnota i je měřítkem odchylky od Raoultova zákona, která se rovná 1, když neexistuje žádná odchylka.
Elektrická vodivost elektrolytů
Arrhenius zkoumal vodivost vodných roztoků elektrolytů, aby zjistil, jak se měnila vodivost s koncentrací elektrolytu.
Měří molární vodivost (což je vodivost odpovídající jednomu molu rozpuštěného elektrolytu; tj. specifická vodivost vztažená na jednoho molu a zjistila, že se ředěním zvyšuje.
Arrhenius porovnal své výsledky s měřením odchylek od Raoultova zákona a našel úzký vztah mezi nimi a molární vodivostí. V jeho teorii je vysvětleno chování elektrolytů:
"Molekuly elektrolytu se rozpadají na elektricky nabité částice zvané ionty." Rozpuštění je neúplné a mezi molekulami a jejich ionty existuje rovnováha. Ionty vedou proud, když se pohybují v rámci řešení “.
Odchylky od Raoultova zákona jsou způsobeny zvýšením počtu částic v důsledku částečné disociace molekul.
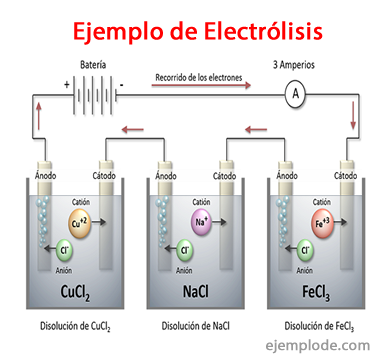
Příklady elektrolýzy
Některá řešení, která se chovají jako elektrolyty, to znamená, že mají kapacitu pro elektrolýzu, jsou:
Chlorid sodný NaCl
Kyselina chlorovodíková HCl
Síran sodný Na2SW4
Kyselina sírová H2SW4
Hydroxid sodný NaOH
Hydroxid amonný NH4Ach
Uhličitan sodný Na2CO3
Hydrogenuhličitan sodný NaHCO3
Kyselina dusičná HNO3
Dusičnan stříbrný AgNO3
Síran zinečnatý ZnSO4