Příklad chemických jevů
Chemie / / July 04, 2021
Chemie studuje jednotlivé složky hmoty, sloučeniny, které tvoří, a jejich možné kombinace produkty, které jsou výsledkem těchto kombinací a jejich struktury, a jevy, které je produkují, urychlují nebo zpomalují modifikace. A Chemický jev je takový, ve kterém dvě nebo více látek prochází změnou, která mění jejich vnitřní strukturu, což vede k vzniku jedné, dvou nebo více látek, odlišný od původní hmoty.
Na rozdíl od fyzikálních jevů, ve kterých se mění některé vlastnosti předmětů, ale vždy jde o stejnou látku nebo sloučenina, ve fyzikálních jevech se struktura látek mění, takže ve výsledku zůstávají jiné látky odlišné od originály. To znamená, že všechny chemické jevy jsou chemické reakce, jejichž výsledkem je jedna nebo více látek, které se molekulárně liší od původní látky nebo látek.
Druhy chemických jevů:
Chemické jevy lze klasifikovat ve vztahu k výsledku následovně:
Syntéza
Dvě nebo více sloučenin se spojí a vytvoří složitější sloučeninu.
Rozklad
Složitá sloučenina se rozpadne a vytvoří jednodušší molekuly.
Přemístění
Jeden z prvků nebo radikál reagujících molekul se stává součástí druhé molekuly, se kterou reaguje.
Dvojité posouvání
Reagující molekuly si vyměňují prvek nebo radikál, čímž vznikají dvě různé molekuly, na které reagovaly.
Pokud jde o reakce jako chemické jevy, můžeme zmínit následující:
Oxidace
Oxidace je reakce, při které se kyslík kombinuje s jiným prvkem, čímž vzniká oxid v případě kovů a kyslíkatá kyselina, pokud se kombinuje s nekovovými prvky. Reakce je pomalá a teplota materiálu se nezvyšuje.

Spalování
Spalování je forma rychlé oxidace, při které se také vydává světlo a teplo, tj. Je to exogenní reakce.
Alkalizace
Je to, když se kov spojí s hydroxylovým radikálem (radikál s formou -OH).
Okyselení
Je to, když je nekovový prvek kombinován s vodíkem
Neutralizace
Jedná se o kombinaci hydroxidu s kyselinou, která vede k tvorbě vody a soli.
Snížení
Jedná se o eliminaci kyslíku z oxidu za účelem získání čistého kovu reakcí s vodíkem z kyseliny.
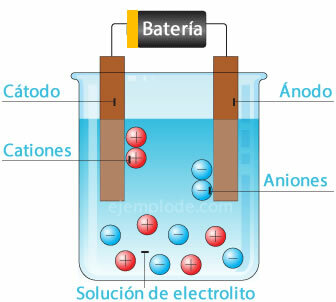
Ionizace
Při rozpouštění soli ve vodě se prvky, které ji tvoří, rozdělí na atomy s elektrickými náboji, které mohou být kladné (kation) nebo záporné (anion). Tyto typy řešení se nazývají elektrolyty.
Elektrolýza
Když elektrický proud prochází elektrolytem, způsobuje elektřina odlomení atomů z vody. vodíkový iont s kladným nábojem směřující k zápornému pólu (katodě) a kyslík s negativním nábojem směřující k pólu pozitivní (anoda). Když se elektrolýza aplikuje v kyselině, jedním z účinků je vytěsnění kovového prvku k anodě.
Katalýza
Dvě látky, které za obecných podmínek nereagují nebo reagují velmi pomalu, mohou reagovat dovnitř velmi rychle v přítomnosti třetí látky, která neprojde změnami před ani během reakce. Tento typ látky se nazývá katalyzátory.
Kvašení
Jedná se o získání chemické změny, zejména v organických sloučeninách, působením bakterií.
Příklad chemických jevů:
1. Nenatřený gril přijde do styku s kyslíkem ve vzduchu a vodě a začne vykazovat rez (oxidaci)
2. Přiblížení dřeva k ohni způsobí hoření, což způsobí některé molekuly uhlíku, které ho tvoří rychle smíchejte s kyslíkem, uvolněte oxid uhličitý a zanechejte spálené dřevo a saze jako zbytek (spalování)
3. Rozklad potravy je způsoben trávením bakterií, které mění chemickou strukturu složek. (Kvašení).
4. Autobaterie vyrábí elektřinu reakcí mezi elektrolytem a kovovými články, se kterými je vyrobena, což způsobuje uvolňování iontů, které vyrábějí elektřinu. K jeho nabití provádí proudový proud elektrolytickou akci, která vrací ionty na desky.
5. Plyny produkované automobilovým motorem jsou stabilní a po opuštění motoru a dosažení pokojové teploty se těžko rozkládají. Katalyzátor obsahuje platinovou pěnu, která při zahřátí na přibližně 500 ° C nechte plyny rozložit se na jednodušší sloučeniny, aniž by byla platina modifikace.
6. Rozpuštěním soli ve vodě se štěpí na ionty sodíku a chloru.
7. Šum, ke kterému dochází, když smícháte citronovou šťávu s jedlou sodou, je neutralizační reakce.
8. Když krvácíme, krev získává tmavší barvu v důsledku oxidace železa nalezeného v červených krvinkách. To je také důvod, proč je venózní krev tmavší a arteriální krev jasnější.
9. Chromování automobilových dílů využívá elektrolýzu k nanášení chromu na chromovanou kovovou část.
10. Při trávení jako chemickém jevu dochází k rozkladu kyseliny chlorovodíkové na potraviny složité molekuly, které je tvoří, na menší molekuly, které lze snadněji absorbovat do střevo.