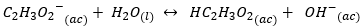20 Eksempler på ætsende stoffer
Miscellanea / / July 04, 2021
Det ætsende stoffer Det er dem, der er i stand til at ødelægge eller irreversibelt beskadige de overflader, som de kommer i kontakt med. For eksempel: svovlsyre, zinkchlorid, kaliumhydroxid.
Ætsende stoffer de er farlige til levende væsner. De kan forårsage irritation eller forbrændinger i væv i huden, øjnene, luftvejene eller mave-tarmkanalen, der meget vel kan føre til døden. Denne type skader kaldes kemiske forbrændinger.
Denne type materialer skal bruges sammen med middel til beskyttelse passende: handsker, tøj, ansigtsmasker. På steder eller containere, hvor ætsende materialer er deponeret eller indeholdt, skal det være (i i henhold til internationale regler) mærke med etiketter, der har et standardikon, der repræsenterer korrosion.

Generelt har ætsende stoffer en pH ekstrem, det vil sige ekstremt sur eller basisk, selvom de også kan være stærkt oxiderende stoffer eller af en anden art. I kontakt med organisk materiale katalyserer syrer hydrolysen af lipider eller denaturering af protein
, som genererer kalorieenergi og hvis fælles virkning fører til den uoprettelige ødelæggelse af vævet. Det baserI stedet tørrer de organisk materiale ud på en ekstrem måde.Eksempler på ætsende stoffer

- Saltsyre. Med formlen HCI og også kendt som saltsyre eller ætsning, kan opnås ved omsætning af natriumchlorid (NaCl) med svovlsyre (H2SW4) eller også producere det under afbrænding af visse plastmaterialer. Den er ekstremt ætsende, og dens koncentrerede opløsning har en pH-værdi lavere end 1, hvorfor den bruges som et reagens, industrielt opløsningsmiddel eller som katalysator i at skaffe andet kemiske stoffer.
- Salpetersyre. Med formlen HNO3, er en viskøs væske, der almindeligvis anvendes som et reagens i laboratoriet. Det bruges til at producere trinitrotoluen (TNT) eller forskellige gødninger såsom ammoniumnitrat (NH4IKKE3). Det kan også findes opløst i sur regn, en kendt miljøfænomen konsekvens af luftfugtighedsforurening.
- Svovlsyre. Dens formel er H2SW4 og det er et af de mest detaljerede produkter i verden, da det ofte bruges til at opnå gødning eller til at syntetisere syrer, sulfater eller endda i den petrokemiske industri. Det er også nyttigt i industri af stål og til fremstilling af alle slags batterier.
- Myresyre. Kendt som methansyre og formel CH2ELLER2, er den enkleste af de organiske syrer, ofte udskilt af insekter ligesom den røde myreFormica rufa) eller bier som en giftig forsvarsmekanisme. Det produceres også af brændenælder, eller det kan findes i sur regn på grund af atmosfærisk forurening. I små mængder kan det forårsage mindre irritationer, men på trods af at det er af naturlig oprindelse er det en ret stærk syre.
- Koncentreret eddikesyre. Også kaldet methylcarboxylsyre eller ethansyre. Dens kemiske formel er C2H4ELLER2, og det er eddikesyren, som giver det sin karakteristiske sure smag og lugt. Det er også en organisk syre, ligesom myresyre, men den er ekstremt svag, så dens anvendelser er varierede og ikke risikable. Alligevel kan det i meget høje koncentrationer være sundhedsfarligt.
- Zinkchlorid. Zinkchlorid (ZnCl2) Det er en solid mere eller mindre hvidt og krystallinsk, meget opløseligt i vand, meget udbredt i tekstilindustrien og som katalysator i laboratoriet. Det er ikke særlig giftigt, men i nærvær af vand reagerer det eksotermt (selv det der i omgivende luft) og kan være særligt ætsende, især for cellulose og silke.
- Aluminiumchlorid. Med formel AlCl3, Det handler om en forbindelse som har sure og basiske egenskaber på samme tid, afhængigt af hvordan det fortyndes. Han er en fattig elektrisk leder når cast og har et punkt af fusion Y kogende lav. Det bruges i kemiske processer som en katalysator for reaktioner, i træbeskyttelse eller i olie krakning. Eksponering for denne forbindelse er ekstremt skadelig for kroppen, da den kan efterlade permanente følgevirkninger på kort tid med eksponering.
- Bortrifluorid. Dens formel er BF3 og det er en farveløs giftig gas, der danner hvide skyer i fugtig luft. Det bruges ofte i laboratoriet som lewis syre og ved opnåelse af andre forbindelser med bor. Det er et ætsende af metaller meget stærk, som i nærværelse af fugtighed kan korrodere rustfrit stål.
- Natriumhydroxid. Kaustisk soda eller kaustisk soda med formlen NaOH er en meget tørrende base, der findes som hvide krystallinske og lugtfri faste stoffer, hvis opløsning i vand eller en syre genererer store mængder varme. Det bruges i procenter mere eller mindre rent i papir-, tekstil- og vaskemiddelindustrien såvel som i olieindustrien.
- Kaliumhydroxid. Kendt som kaustisk kaliumchlorid og med den kemiske formel KOH, er det en stærkt tørremiddel uorganisk forbindelse, hvis naturlige korrosivitet anvendes i applikationer som en forsæber af fedt (ved at få sæbe). Dens opløsning i vand er eksoterm, det vil sige det genererer kalorieenergi.
- Natriumhydrid. Med formlen NaH er det et meget dårligt opløseligt stof i opløsningsmidler organisk, er gennemsigtig i farve og er klassificeret som en grundlag stærk, da den er i stand til at deprotonisere forskellige svage syrer. Derudover er det et kraftigt tørremiddel, gemmer enorme mængder brint, er meget ætsende og meget brandfarligt.
- Dimethylsulfat. Under normale forhold er denne forbindelse med kemisk formel C2H6ELLER4S er en farveløs, olieagtig væske med en let løgslugt, opført som en stærk alkylator. Det er meget giftigt: kræftfremkaldende, mutagent, ætsende og giftigt, så dets anvendelse i laboratoriemetyleringsprocesser erstattes normalt med andre mere sikre reagenser. Det er også farligt for miljøet, hvorfor det ofte er blevet betragtet som et sandsynligt kemisk våben.
- Phenol (carbolsyre). Af kemisk formel C6H6Eller og adskillige alternative navne, denne forbindelse i sin rene form er et hvidt eller farveløst krystallinsk fast stof, som kan syntetiseres fra oxidation af benzen. Det er meget efterspurgt i harpiksindustrien såvel som i fremstillingen af nylon, men også som en komponent i fungicider, antiseptiske midler og desinfektionsmidler. Det er let brandfarligt og ætsende.
- Acetylchlorid. Også kaldet ethanoylchlorid, det er et halogenid afledt af ethansyre, der er farveløst ved stuetemperatur og tryk. Det er en forbindelse, der ikke eksisterer i naturen, da den i nærværelse af vand nedbrydes til ethansyre (C2H4ELLER2) og saltsyre (HCI). Det bruges i vid udstrækning som et farvestof, desinfektionsmiddel, insekticid og endda som et bedøvelsesmiddel på trods af at det er ætsende ved reaktion.
- Natriumhypochlorit. Kendt som blege Når den er opløst i vand, er denne forbindelse med den kemiske formel NaClO en stærk oxidant og reagerer med chlorider til dannelse af letalt giftige gasser af klor (Cl2). Det bruges som blegemiddel, vandrenser og desinfektionsmiddel, da det i visse koncentrationer har evnen til at opløse organisk materiale.
- Benzylchlorformiat. Det er en olieagtig væske med en ubehagelig lugt, der kan variere fra farveløs til gullig og har den kemiske formel C8H7ClO2. Det kan opnås ved omsætning af phosgen med benzylalkohol. Det er kræftfremkaldende og meget ætsende, farligt for miljøet og vanddyr.
- Elementære alkalimetaller. Ethvert alkalimetal i sin reneste eller elementære form, såsom lithium (Li), natrium (Na), kalium (K), rubidium (Rb), cæsium (Cs) og Francio (Fr), det reagerer meget hurtigt med ilt og vand, så de aldrig ses i naturen i deres tilstand elementære. I begge tilfælde reagerer de voldsomt og genererer meget varme, hvorfor de kan være irriterende eller ætsende og sundhedsfarlige.
- Diphosphorpentoxid. Kendt som fosforoxid (V) eller fosforoxid, er et hvidt pulver med molekylformel P2ELLER5. At være ekstremt hygroskopisk (tørremiddel), har meget ætsende egenskaber, og dets kontakt af enhver art med kroppen bør undgås. Desuden producerer dets opløsning i vand en stærk syre, der reagerer i nærvær af metaller og genererer giftige og brandfarlige gasser.
- Calciumoxid. Opkald hurtigkalk og med den kemiske formel CaO er det et stof, som mennesket har længe brugt, og som er opnået fra kalksten. Det har applikationer inden for byggeri og landbrug da det ikke er giftigt eller ætsende, men når det blandes med vand, reagerer det eksotermt, så det kan irritere luftvejene, huden eller forårsage alvorlig øjenskade.
- Koncentreret ammoniak. Normalt er ammoniak, en farveløs gas med en frastødende lugt sammensat af nitrogen og brint (NH3), produceres i forskellige organiske processer, der frigiver det til miljøet på grund af dets toksicitet. Faktisk er det til stede i human urin, og det kan frigives i miljøet i form af ammoniakanhydrid, som er meget skadeligt og giftigt.
Følg med: