20 Beispiele für chemische Phänomene
Verschiedenes / / July 04, 2021
Das chemische Phänomene (oder chemische Reaktionen) sind solche Phänomene, bei denen Veränderungen in der Materie auftreten und neue Substanzen, die als "Produkte" bezeichnet werden, gebildet werden und andere Substanzen, die als "Reaktanten" bezeichnet werden, sich zersetzen. Beispielsweise: Holzfäule, Papierverbrennung, Kompostierung.
Chemische Reaktionen können sein spontan (Reaktionen, die ohne Energie- oder Katalysatorbedarf ablaufen) oder nicht spontan (Reaktionen, die den Beitrag von Energie, Katalysatoren oder einer externen Intervention erfordern). Für eine Reaktion ist es oft notwendig, dass die Reagenzien eine Temperatur spezifisch, a pH ein eingestellter Druckwert usw.
Es kann auch wichtig sein, die Geschwindigkeit zu denen chemische Reaktionen ablaufen. Das Katalysatoren Sie sind Substanzen, die einer chemischen Reaktion zugesetzt werden, um deren Geschwindigkeit zu erhöhen, während Inhibitoren Substanzen sind, die die Geschwindigkeit chemischer Reaktionen verlangsamen. Andere Faktoren, die die Geschwindigkeit einer chemischen Reaktion beeinflussen, sind Temperatur, Druck, die Konzentration der Reaktanten und die Art der Reaktion selbst.
Es kann Ihnen dienen:
Arten von chemischen Phänomenen
Chemische Reaktionen können sein:
Anorganische Reaktionen. Eingreifen Anorganische Verbindungen und lässt sich einteilen nach:
- Der Sinn, in dem die Reaktion stattfindet.
-
Reversible Reaktionen. Sie treten in beide Richtungen auf, sodass die Produkte zerfallen und wieder die Reaktionspartner bilden können.
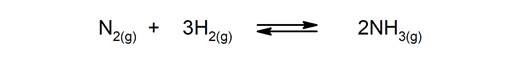
-
Irreversible Reaktionen. Sie passieren nur auf eine Weise.

-
Reversible Reaktionen. Sie treten in beide Richtungen auf, sodass die Produkte zerfallen und wieder die Reaktionspartner bilden können.
- Die Art des Teilchens, das reagiert.
-
Säure-Base-Reaktionen. H-Ionen-Transfer tritt auf+.

-
Oxidations-Reduktions-Reaktionen. Einer der Reaktanten oxidiert (erhöht seine Anzahl von Oxidation), während der andere reduziert wird (seine Oxidationszahl sinkt). Bei diesen Reaktionen findet ein Elektronentransfer statt.

-
Säure-Base-Reaktionen. H-Ionen-Transfer tritt auf+.
- Die Reaktionsgeschwindigkeit.
-
Schnelle Reaktionen. Sie treten in sehr kurzer Zeit auf.
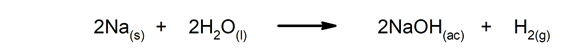
-
Langsame Reaktionen Sie dauern lange, bis sie fertig sind.
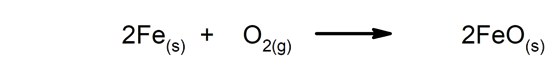
-
Schnelle Reaktionen. Sie treten in sehr kurzer Zeit auf.
- Die Form der Energie, die es emittiert oder absorbiert.
-
Exotherme Reaktionen. Wenn sie auftreten, geben sie Wärme ab.
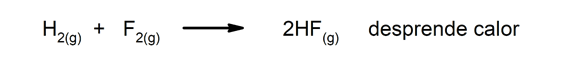
-
Endotherme Reaktionen. Wenn sie auftreten, nehmen sie Wärme auf.

-
Exoluminöse Reaktionen. Wenn sie auftreten, emittieren sie Licht.

-
Endoluminöse Reaktionen. Dazu brauchen sie Licht.

-
Exotherme Reaktionen. Wenn sie auftreten, geben sie Wärme ab.
- Die Art der Transformation.
-
Synthese- oder Additionsreaktionen. Zwei Stoffe verbinden sich zu einem neuen Stoff.
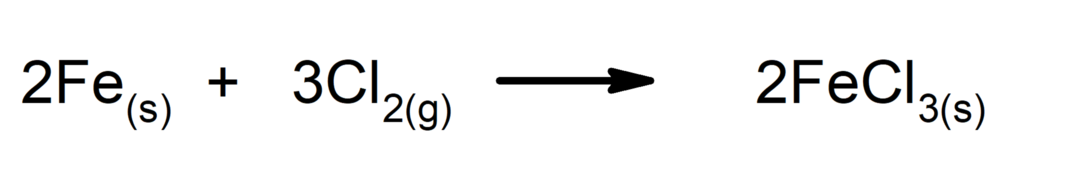
-
Zersetzungsreaktionen. Ein oder mehrere Stoffe zerfallen in ihre einfachsten Bestandteile.
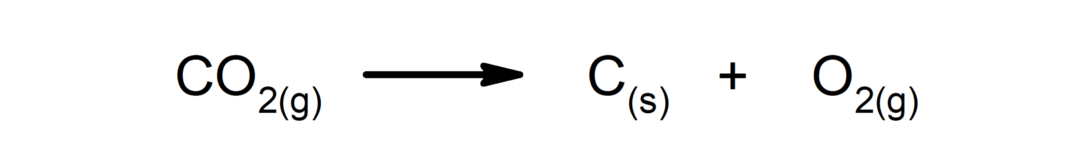
-
Verdrängungs- oder Substitutionsreaktionen. Ein Element oder eine Verbindung ersetzt ein anderes in einer Verbindung und setzt es frei.
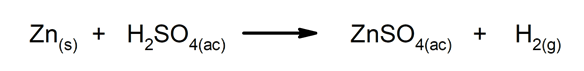
-
Doppelsubstitutionsreaktionen. Zwei Verbindungen tauschen gleichzeitig Elemente oder Verbindungen aus.

-
Synthese- oder Additionsreaktionen. Zwei Stoffe verbinden sich zu einem neuen Stoff.
Organische Reaktionen. Es sind Reaktionen, in die organische Verbindungen eingreifen. Sie haben viele Klassifizierungen, die auf der Art der reagierenden organischen Verbindung und der Art der Reaktion basieren, die sie durchläuft. Einige Beispiele sind:
-
Halogenierung von Alkanen. Ein Wasserstoff ersetzt a alkan durch ein Halogen.
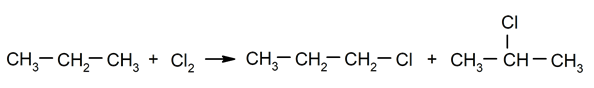
-
Verbrennung von Alkanen. Ein Alkan reagiert mit Sauerstoff zu Kohlendioxid und Wasser, wenn die Verbrennung abgeschlossen ist.
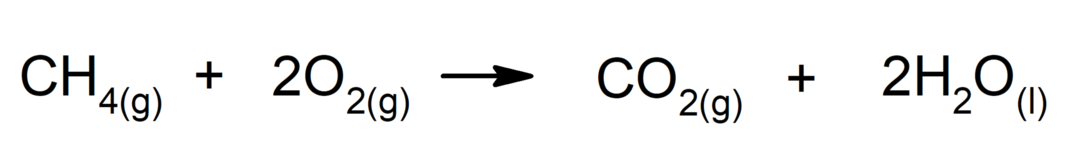
-
Halogenierung von Alkene. Halogene ersetzen einen oder beide Wasserstoffe der Kohlenstoffe, die an der Doppelbindung beteiligt sind.
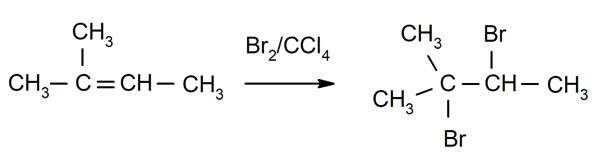
-
Hydrierung von Alkenen. Wasserstoffe werden an die an der Doppelbindung beteiligten Kohlenstoffe addiert, um das entsprechende Alkan zu bilden.
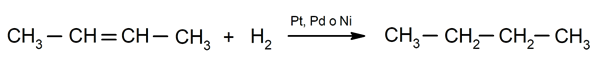
Bedeutung chemischer Phänomene
Viele chemische Phänomene Leben erhalten von Lebewesen, wie die Verdauung beim Menschen und Tiere, Photosynthese bei Pflanzen und Atmung bei beiden.
Ein weiterer sehr wichtiger chemischer Prozess, insbesondere im Leben von Mikroorganismen, ist der Fermentation, das normalerweise bei der Herstellung von Lebensmittel wie Käse, Joghurt, Wein und Bier.
All die erhöhen, ansteigen und der Wachstum von a Lebewesen Es beinhaltet chemische Reaktionen, die darin stattfinden, manchmal durch bestimmte Umweltbedingungen stimuliert.
Beispiele für chemische Phänomene
Um uns herum gibt es zahlreiche Fälle von chemischen Phänomenen oder Prozessen, die sie beinhalten:
- Holzfäule
- Verbrennung aus Papier
- Beständigkeit gegen Antibiotika Bakterien
- Milch, die sauer wird
- Wunddesinfektion mit Alkohol
- Mit Fruchtsalz gegen Sodbrennen
- Eine Kerze brennen
- Blutgerinnung
- Muskelermüdung nach intensivem Training
- Tod von Insekten durch Insektizide
- Roquefort-Käse gewinnen
- Apfelwein beziehen
- Joghurt beziehen
- Kompostierung
- Silage
- Gewinnung von Bioethanol aus Melasse
- Geschwollene Blechdosen
- Verdorbenes Ei
- Rosten eines Rostes
- Biodiesel aus Palmöl gewinnen
Chemische Phänomene in der Industrie
Bestimmte chemische Phänomene sind auch für dieIndustrie. Zunächst wird die Verbrennung von Kohlenwasserstoffe (wie Benzin, Diesel oder Kerosin) produziert Energie um die Maschinen zu betreiben, die unzählige industrielle Prozesse abwickeln.
Auf der anderen Seite ist die Stahlindustrie, Papier, Kunststoffe, Baustoffe, Farben, Medikamente, Produkte für die agro usw. basieren auf verschiedenen chemischen Phänomenen wie Galvanisierung, Elektrolyse und vielen andere mehr.
Die Generation von neue Energiequellen (wie Biodiesel und Bioethanol) basiert ebenfalls auf diesem Phänomen.
Die Umwandlung von Energie
Bei chemischen Phänomenen ist es üblich, dass es Energieumwandlung. Zum Beispiel, wenn die in den Bindungen eines bestimmten Moleküls enthaltene chemische Energie in elektrische Energie umgewandelt oder als Hitze (dies tritt bei exothermen Phänomenen auf, z. B. beim Mischen von Salzsäure mit Zink), kommt es zu einer Umwandlung von Energie. Das gleiche passiert, wenn Lichtenergie eingefangen und in chemische Energie umgewandelt wird.
Einige chemische Prozesse benötigen zum Ablaufen Wärme und werden als "endotherm" bezeichnet. Andere erfordern die Anwesenheit von Katalysatoren oder Cofaktoren.



