100 Beispiele für chemische Elemente
Verschiedenes / / November 13, 2021
Das chemische Elemente sind eine Art von Angelegenheit, die durch kein Verfahren oder chemische Reaktion sie können in andere einfachere Elemente reduziert oder zerlegt werden. Aus diesem Grund kann man sagen, dass ein Element alles ist Angelegenheit hergestellt von Atome der gleichen und einzigartigen Klasse, d. h. Atome mit derselben Ordnungszahl (gleiche Anzahl von Protonen), obwohl sie eine unterschiedliche Atommasse haben. Beispielsweise: Schwefel, Bor, Chrom, Zinn.
Die erste Definition eines chemischen Elements wurde eingeführt von Lavoisier in dem Traité Élémentaire de Chimie, 1789. Bereits im 18. Jahrhundert unterteilte Lavoisier einfache Substanzen in vier Gruppen:
Periodensystem
Heute kennen sie sich 118 chemische Elemente. Sie alle sind nach vielen ihrer Eigenschaften in einem grafischen Schema, das als Periodensystem der Elemente bekannt ist und ursprünglich von dem russischen Chemiker erstellt wurde, gesammelt, klassifiziert und organisiert Dimitri Mendelejew im Jahr 1869. Das Periodensystem besteht aus 18 Gruppen (Spalten) und 7 Perioden (Reihen), in denen sich die chemischen Elemente befinden.
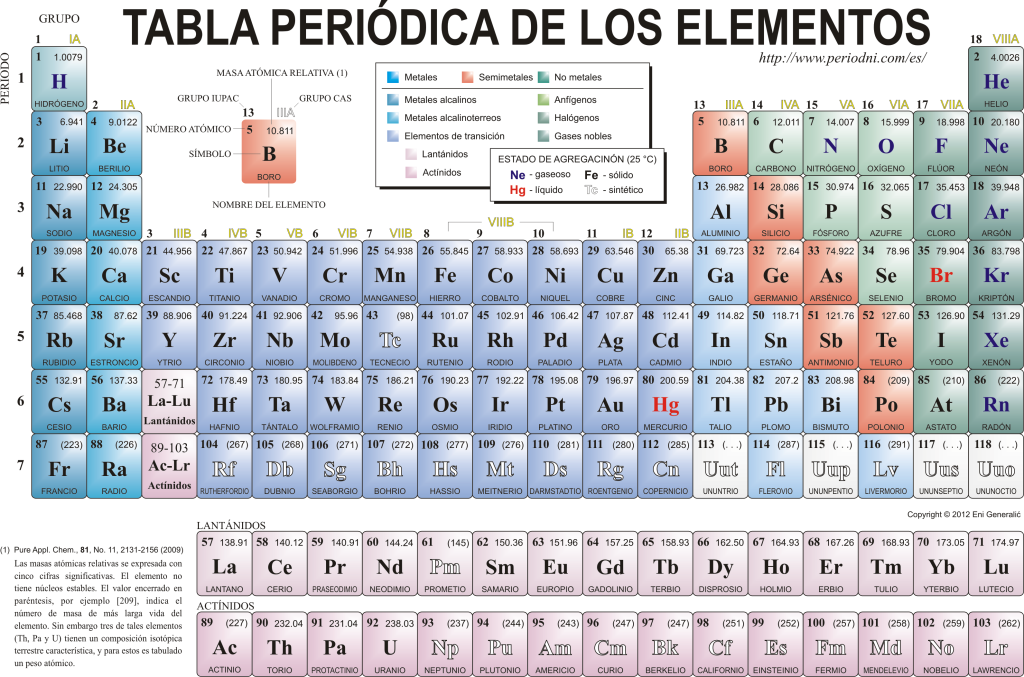
Das Hauptgruppen die in dieser Tabelle zu finden sind:
Die Alkalimetalle (Gruppe 1), die Erdalkalimetalle (Gruppe 2), die Scandiumfamilie, zu der die Erden und Aktiniden gehören (Gruppe 3), die Titanfamilie (Gruppe 4), die Vanadium-Familie (Gruppe 5), die Chrom-Familie (Gruppe 6), die Mangan-Familie (Gruppe 7), die Eisen-Familie (Gruppe 8), die Kobalt-Familie (Gruppe 9), die Nickelfamilie (Gruppe 10), die Kupferfamilie (Gruppe 11), die Zinkfamilie (Gruppe 12), Erdelemente (Gruppe 13), Karbonidelemente, in dieser Gruppe ist Kohlenstoff, die Grundlage des Lebens auf der Erde (Gruppe 14), stickstoffbildende Elemente (Gruppe 15), amphigenetische Elemente, beinhaltet Sauerstoff, ein Grundelement für element das Atmung des Lebewesen (Gruppe 16), Halogenelemente (Gruppe 17) und Edelgase (Gruppe 18).
Viele dieser Elemente haben stabile oder radioaktive Isotope, d. h. dasselbe chemische Element, zum Beispiel Wasserstoff (H), kann mehrere Isotope haben (1H, 2H, 3H). Dies bedeutet, dass jedes Isotopenatom die gleiche Anzahl von Protonen hat (was bedeutet, dass es zum gleichen chemischen Element gehört) und eine unterschiedliche Anzahl von Neutronen.
Einige Isotope sind nicht stabil (radioaktiv), d.h. zerfallen in einer bestimmten Zeit bestimmte Teilchen emittieren (Neutronen, Photonen, Alphateilchen u. a.) und andere stabile oder radioaktive Isotope erzeugen. Chemische Elemente haben Eigenschaften wie den Punkt von Sieden und das von Verschmelzung, Elektronegativität, Dichte und Ionenradius, unter anderem. Diese Eigenschaften sind wichtig, weil sie es uns ermöglichen, ihr Verhalten, ihre Reaktivität usw. vorherzusagen.
Wie werden die Elemente im Periodensystem dargestellt?
Jedes chemische Element ist charakterisiert durch die Periodensystem unter Verwendung einer bestimmten Symbolik. Erstens, in der Mitte jedes Quadrats sein universelles Symbol, das aus einem oder zwei besteht Buchstaben (bei zwei Buchstaben wird der erste groß und der nächste klein geschrieben).
Oben und links erscheint in kleiner Schrift Su Ordnungszahl, die die Menge an Protonen angibt, die dieses Element hat. Unterhalb des Elementsymbols erscheint sein Name und links oben sein Name. Atommasse relativ. Darüber hinaus gibt die Farbe, in der das Elementsymbol dargestellt wird, seinen Aggregatzustand an (gemäß der in jedem Periodensystem verwendeten Darstellung).
Die verschiedenen Elemente vorhanden Atomradien Variablen und je größer die Anzahl der Protonen im Kern ist, desto größer ist die Anziehung, die der Kern auf die Elektronen ausübt, so dass der Atomradius tendenziell kleiner wird. Wenn der Atomradius klein ist, werden die Elektronen auf der äußersten Ebene der Wolke sehr vom Kern angezogen, sodass sie nicht so leicht aufgeben. Bei Elementen mit hohen Atomradien passiert das Gegenteil: Sie geben leicht ihre äußeren Elektronen ab.
Somit nimmt der Atomradius von oben nach unten zu, wenn wir die Gruppen des Periodensystems durchlaufen, und nimmt von links nach rechts ab, wenn wir ihre Perioden durchlaufen.
Beispiele für chemische Elemente
| Chemisches Element | Symbol |
| Aktinium | Ac |
| Aluminium | Zum |
| Amerika | A. M |
| Antimon | Sb |
| Argon | Ar |
| Arsen | As |
| Astat | Beim |
| Schwefel | S |
| Barium | Ba |
| Beryllium | Sein |
| Berkelium | Bk |
| Wismut | Bi |
| Bohrio | Bh |
| Bor | B |
| Brom | Br |
| Cadmium | CD |
| Kalzium | AC |
| Kalifornien | Vgl |
| Kohlenstoff | C |
| Cer | EC |
| Cäsium | Cs |
| Chlor | Cl |
| Kobalt | Co |
| Kupfer | Cu |
| Chrom | Cr |
| Kurium | Cm |
| Darmstadion | Ds |
| Dysprosium | Dy |
| Dubnium | Db |
| Einsteinium | Es ist |
| Erbium | Er |
| Scandium | Sc |
| Zinn | Sn |
| Strontium | Herr |
| Europa | EU |
| Fermium | Fm |
| Fluor | F |
| Spiel | P |
| Francius | Fr |
| Gadolinium | Gott |
| Gallium | Ga |
| Germanium | Ge |
| Hafnium | Hf |
| Hassio | Hs |
| Helium | ich habe |
| Wasserstoff | H |
| Eisen | Vertrauen |
| Holmium | Ho |
| indisch | Im |
| Jod | ich |
| Iridium | Gehen |
| Ytterbium | Yb |
| Yttrium | Ja |
| Krypton | Kr |
| Lanthan | Das |
| Lawrencio | Lr |
| Lithium | Li |
| Lutetium | Montag |
| Magnesium | Mg |
| Mangan | Mn |
| Meitnerius | Berg |
| Mendelevium | Md |
| Merkur | Hg |
| Molybdän | Mo |
| Neodym | N / A |
| Neon | Ne |
| Neptunium | Np |
| Niob | Nb |
| Nickel | Weder |
| Stickstoff | Nein |
| Nobelio | Nicht |
| Gold | Au |
| Osmium | Sie |
| Sauerstoff | ODER |
| Palladium | PS |
| Silber | Ag |
| Platin | Pt |
| Führen | Pb |
| Plutonium | Pu |
| Polonium | Po |
| Kalium | K |
| Praseodym | Pr |
| Versprechen | Uhr |
| Protactinium | Pa |
| Radio | Ra |
| Radon | Rn |
| Rhenium | Re |
| Rhodium | Rh |
| Rubidium | Rb |
| Ruthenium | Ru |
| Rutherfordio | Rf |
| Samarium | Ihr |
| Seaborgio | Sg |
| Selen | ich weiß |
| Silizium | Ja |
| Natrium | N / A |
| Thallium | Tl |
| Tantal | Ta |
| Technetium | Tc |
| Tellur | Tee |
| Terbium | Tb |
| Titan | Sie |
| Thorium | Das |
| Thulium | Tm |
| Kopernikus | Cn |
| Livermorio | Lv |
| Röntgenio | Rg |
| Ununoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Unseptio | Uus |
| Ununtrium | Uut |
| Uran | ODER |
| Vanadium | V |
| Wolfram | W |
| Xenon | Xe |
| Zink | Zn |
| Zirkonium | Zr |

Folge mit:
