50 Beispiele für Aldehyde und Ketone
Beispiele / / November 06, 2023
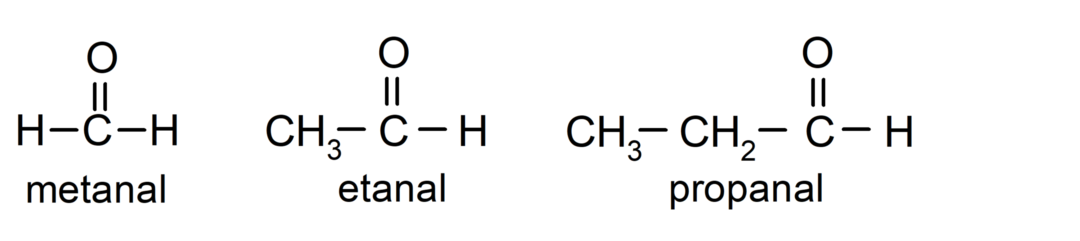
Der Aldehyde Sind organische Verbindungen die in ihrer Struktur eine funktionelle Carbonylgruppe (= C = O) aufweisen, die an eine Kohlenstoffkette und ein Wasserstoffatom gebunden ist. Zum Beispiel: Methanal (auch Formaldehyd genannt), Ethanal (auch Acetaldehyd genannt) und Propanal (auch Propaldehyd genannt).
Der Ketone Es handelt sich um organische Verbindungen, die in ihrer Struktur eine Carbonylgruppe aufweisen, die an zwei Kohlenstoffatome gebunden ist. Zum Beispiel: Propanon (auch Aceton genannt), Butanon und 2-Pentanon.
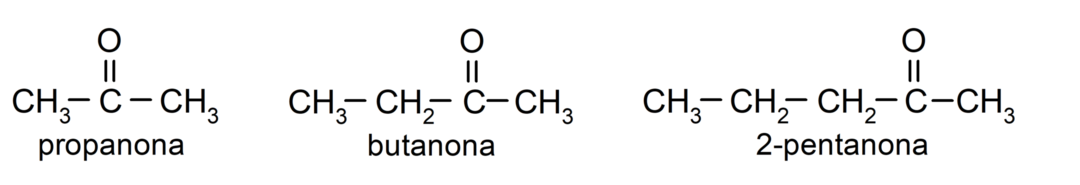
Unterschiede zwischen Aldehyden und Ketonen
Die Hauptunterschiede zwischen Aldehyden und Ketonen sind:
- Aldehyde haben in ihrer Struktur eine funktionelle Carbonylgruppe an einem terminalen Ende. während sich bei Ketonen die Carbonylgruppe an nichtterminalen Positionen befindet Struktur.
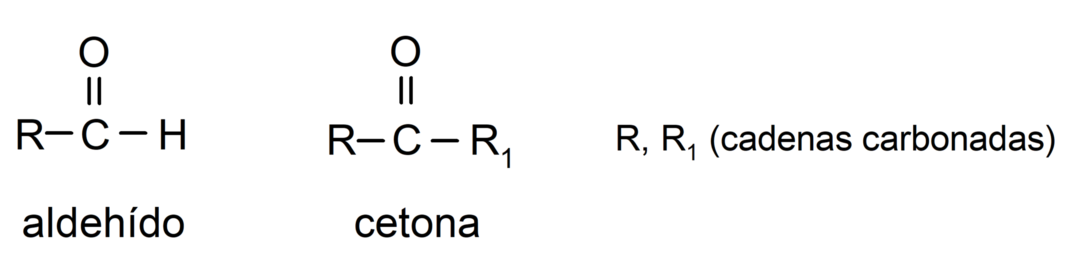
- Aldehyde werden durch Reaktion mit dem Tollens-Reagenz oxidiert und bilden metallisches Silber. Sie oxidieren auch gegen Benedicts Reagenz und bilden Kupferoxid. Ketone werden von keinem der beiden Reagenzien oxidiert.
- Aldehyde werden zu primären Alkoholen reduziert, während Ketone zu sekundären Alkoholen reduziert werden.
Physikalische Eigenschaften
Physikalische Eigenschaften von Aldehyden
Die physikalischen Eigenschaften von Aldehyden sind sehr vielfältig, da sie von der Beschaffenheit der Kohlenstoffkette abhängen, die mit der Carbonylgruppe verbunden ist.
Einige sind:
- Die am besten wasserlöslichen Aldehyde sind kleinere Aldehyde wie Methanal und Ethanal.
- Flüchtige Aldehyde haben einen stechenden und sogar reizenden Geruch.
- Die Carbonylgruppe verleiht ihnen Polarität.
- Sie haben normalerweise einen höheren Siedepunkt als chemische Verbindungen mit ähnlicher Molekülgröße.
Physikalische Eigenschaften von Ketonen
Die physikalischen Eigenschaften von Ketonen hängen davon ab, wie die Kohlenstoffkette gebildet wird, die mit der Carbonylgruppe verbunden ist.
- Viele Ketone haben angenehme Gerüche.
- Seine Löslichkeit in Wasser hängt von der Größe der an die Carbonylgruppe gebundenen Kohlenstoffkette ab. Je kleiner die Kohlenstoffkette, desto löslicher ist das Keton in Wasser.
- Die Carbonylgruppe verleiht ihnen eine ausgeprägte Polarität.
- Sie haben im Vergleich zu chemischen Verbindungen vergleichbarer Molekülgröße einen relativ hohen Siedepunkt.
Chemische Eigenschaften
Chemische Eigenschaften von Aldehyden
Zu den chemischen Eigenschaften von Aldehyden zählen:
Sie werden zur entsprechenden Carbonsäure oxidiert, das heißt, die gebildete Säure hat die gleiche Anzahl an Kohlenstoffen in der Kohlenstoffkette wie die Aldehyd das hat dazu geführt. Zum Beispiel:
- Oxidation mit Tollens-Reagenz (ammoniakalischer Silberkomplex in basischer Lösung, [Ag (NH).3)2]+) aus Ethanal erzeugt Ethansäure und metallisches Silber.
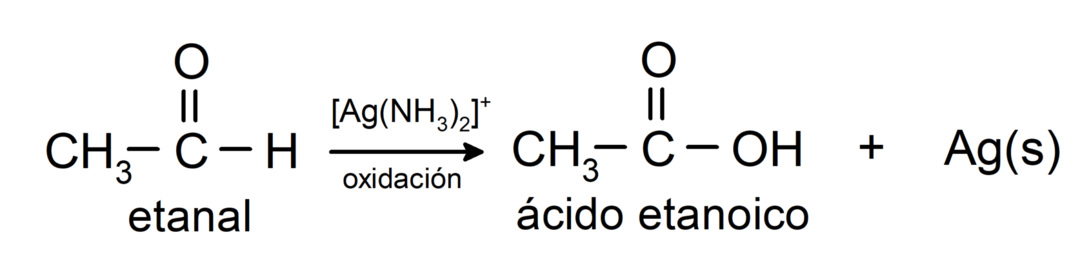
- Durch Oxidation von Ethanal mit Benedicts Reagenz (alkalische Lösung von Kupfersulfat) entstehen Ethansäure und Kupferoxid.
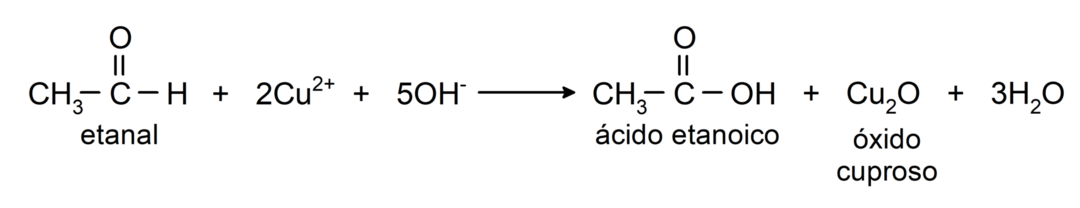
Sie durchlaufen nukleophile Additionsreaktionen, also Addition eines Nukleophils an die Carbonylgruppe. Zum Beispiel:
- Zugabe von Blausäure zur Bildung von Cyanhydrinen bzw. Cyanhydrinen.
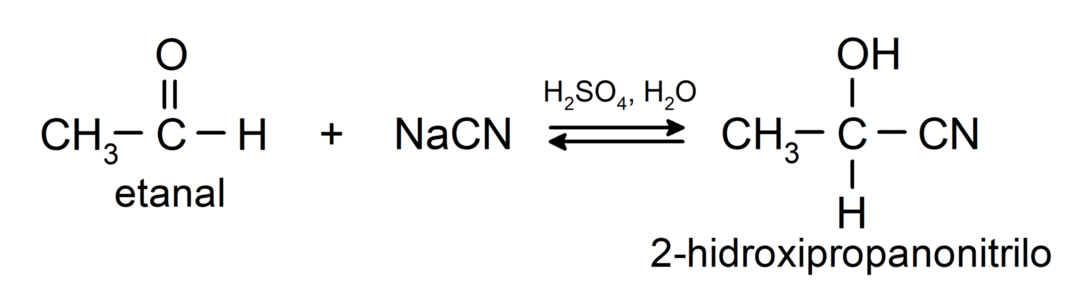
- In Gegenwart wasserfreier Säuren addieren sich Alkohole an die Carbonylgruppe von Aldehyden und bilden Acetale und Halbacetale.
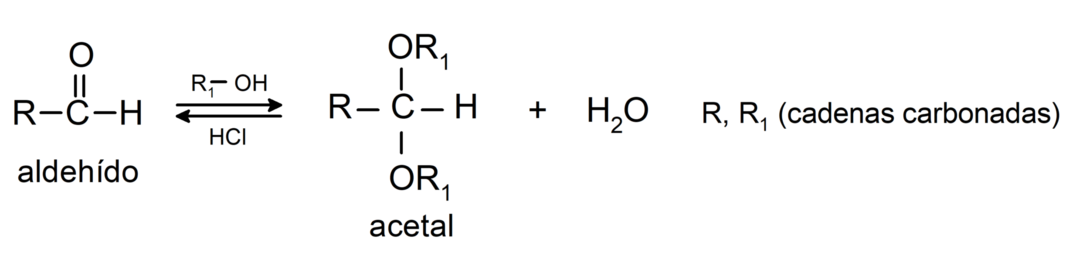
Sie durchlaufen Aldolkondensationsreaktionen. Bei diesen Reaktionen erfolgt die Vereinigung zweier Aldehyde in Gegenwart von Natriumhydroxid (NaOH) und dem chemische Verbindung Das resultierende wird Aldol genannt. Zum Beispiel:
- Kondensationsreaktion von Ethanal in Gegenwart von verdünnter NaOH.
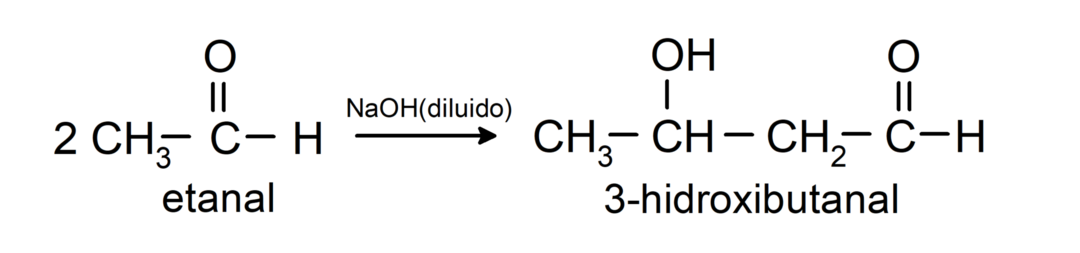
Sie werden zu primären Alkoholen reduziert. Aldehyde können durch katalytische Hydrierung oder durch Reduktion mit Natriumborhydrid (NaBH) zu primären Alkoholen reduziert werden.4) und Lithiumaluminiumhydrid (LiAlH4).
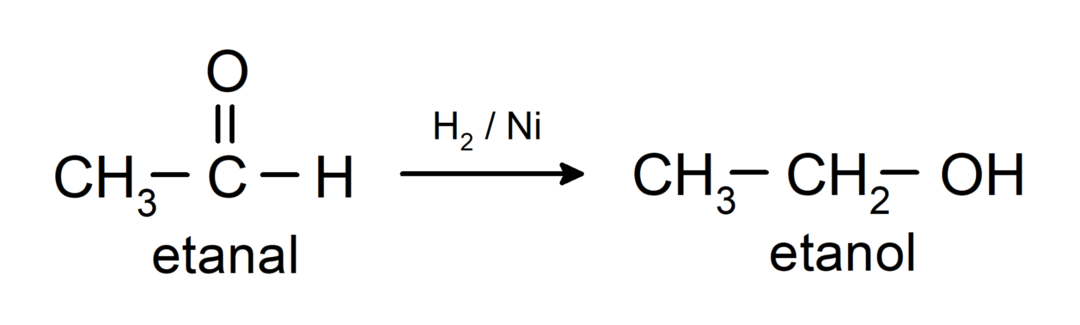
Chemische Eigenschaften von Ketonen
Zu den chemischen Eigenschaften von Ketonen zählen:
Sie durchlaufen nukleophile Additionsreaktionen. Zum Beispiel:
- Zugabe von Blausäure zur Bildung von Cyanhydrinen bzw. Cyanhydrinen.
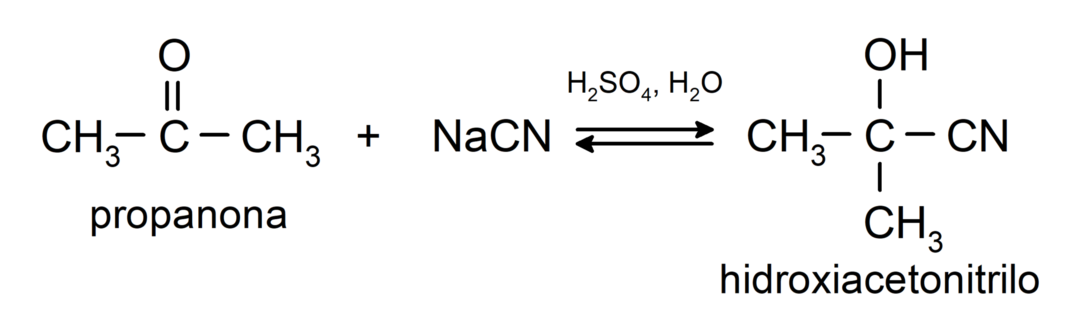
Sie fügen Alkohole hinzu (in Gegenwart wasserfreier Säuren) an die Carbonylgruppe von Ketonen unter Bildung von Ketalen und Halbketalen. Zum Beispiel:
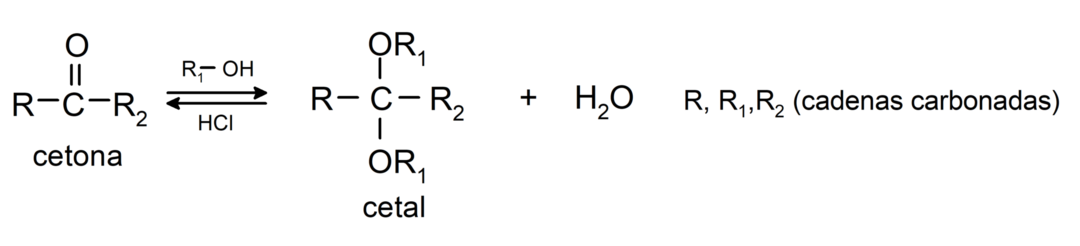
Sie unterliegen Halogenierungsreaktionen. Ketone mit einem Alpha-Wasserstoff (α) reagieren durch Ersetzen dieses Wasserstoffs durch Halogene (Chlor (Cl), Brom (Br), Jod (I), Fluor (F)) in Gegenwart saurer oder basischer Katalysatoren. Die Substitution erfolgt fast ausschließlich im Kohlenstoff α, also der Kohlenstoff, der sich an Wasserstoff gebunden hat α. Zum Beispiel:
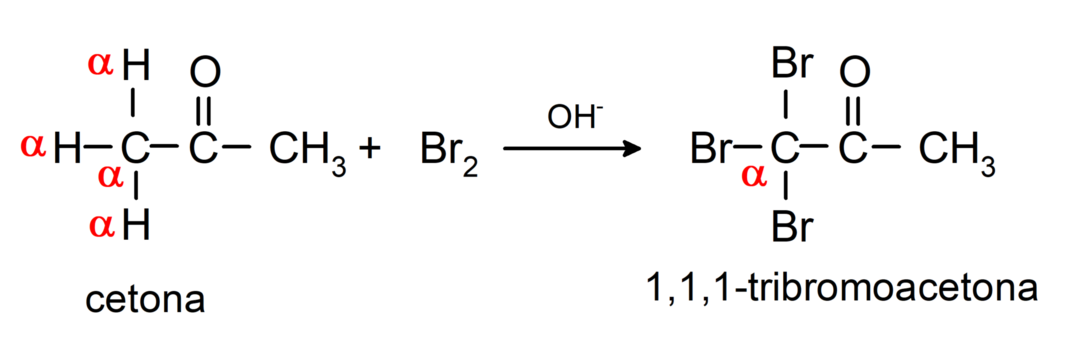
Sie werden zu sekundären Alkoholen reduziert durch katalytische Hydrierung oder durch Reduktion mit Natriumborhydrid (NaBH).4) und Lithiumaluminiumhydrid (LiAlH4). Zum Beispiel:
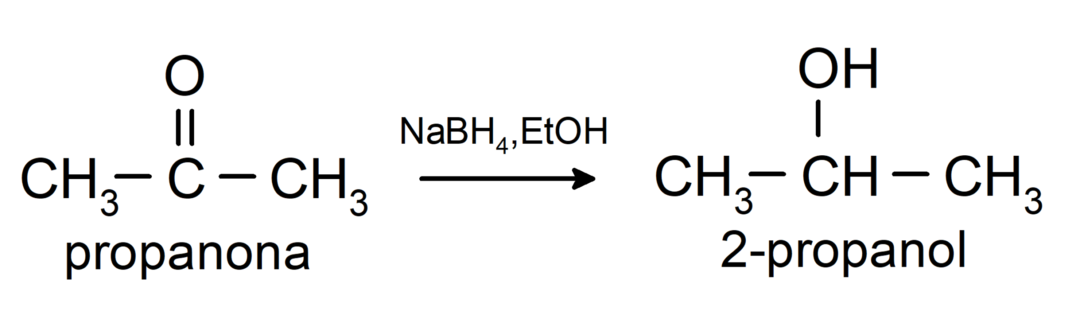
Ketone werden durch Tollens- und Benedict-Reagenzien nicht oxidiert.
Nomenklatur der Aldehyde
Gemäß den von der International Union of Pure and Applied Chemistry (IUPAC) festgelegten Regeln Aldehyde werden mit Präfixen benannt, die die Anzahl der Kohlenstoffatome in der Kette angeben. mit Kohlensäure. Es ist nicht notwendig, die Position der Carbonylgruppe anzugeben, da sie sich immer an Position eins, an einem Ende des Moleküls, befindet. Zusätzlich wird am Ende des Aldehydnamens das Suffix -al geschrieben. Zum Beispiel:
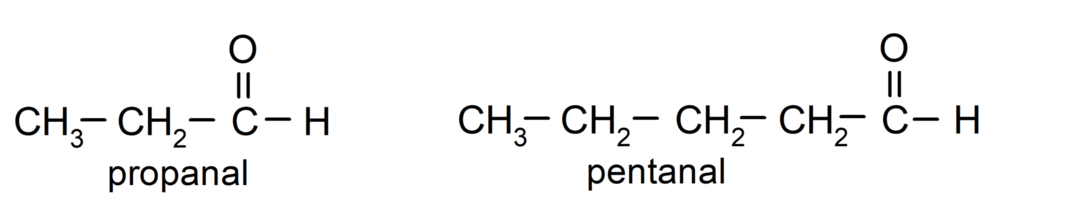
Wenn der Aldehyd aus mehreren Kohlenstoffketten aufgebaut ist, also Verzweigungen aufweist, wird die Kohlenstoffkette mit der größten Anzahl an Kohlenstoffatomen als Hauptkette gewählt. Die anderen Ketten werden als Substituentengruppen bezeichnet und die Position jedes Substituenten wird so gewählt, dass er die kleinstmögliche Anzahl in der Kette einnimmt. Darüber hinaus beginnt die Zählung der Kohlenstoffatome beginnend an dem Ende, das die Carbonylgruppe trägt. Zum Beispiel:
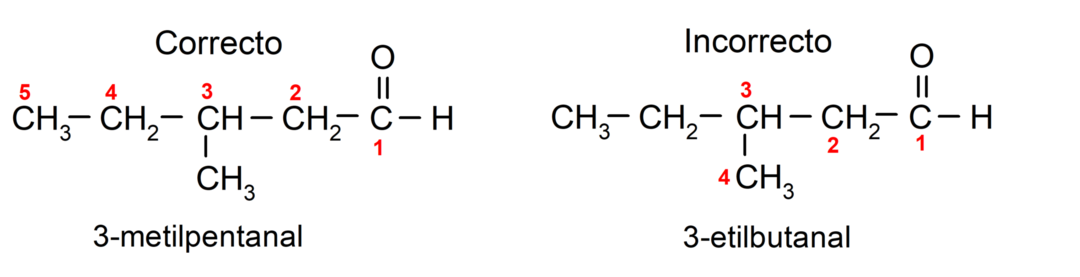
Aldehyde, die über zwei Carbonylgruppen verfügen, werden mit dem Suffix -dial benannt. Zum Beispiel:
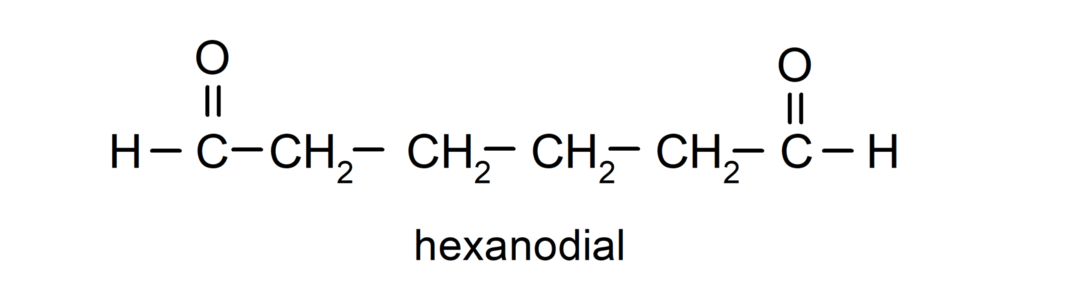
Keton-Nomenklatur
Nach Angaben der International Union of Pure and Applied Chemistry (IUPAC) werden Ketone mit Präfixen benannt, die die Anzahl der Kohlenstoffe in der Kohlenstoffkette angeben.
Andererseits wird der Name Aceton mit dem Suffix -one geschrieben, dem eine Zahl vorangestellt ist, die die Position der Carbonylgruppe in der Kohlenstoffkette angibt. Die Position der Carbonylgruppe sollte so gewählt werden, dass sie einer möglichst niedrigen Nummerierung entspricht. Zum Beispiel:
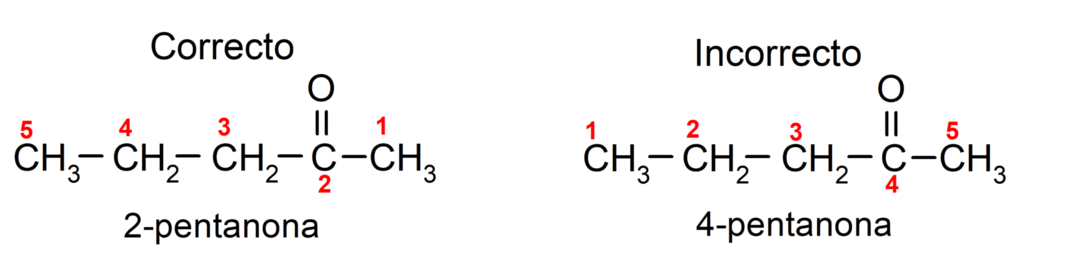
Um ein Keton zu benennen, das aus mehreren Kohlenstoffketten, also mit Verzweigungen, besteht, wählen wir Als Hauptkette gilt die Kohlenstoffkette mit der größten Anzahl an Kohlenstoffatomen, die die Gruppe enthält Carbonyl. Die restlichen Ketten werden als Substituentengruppen bezeichnet. Zum Beispiel:
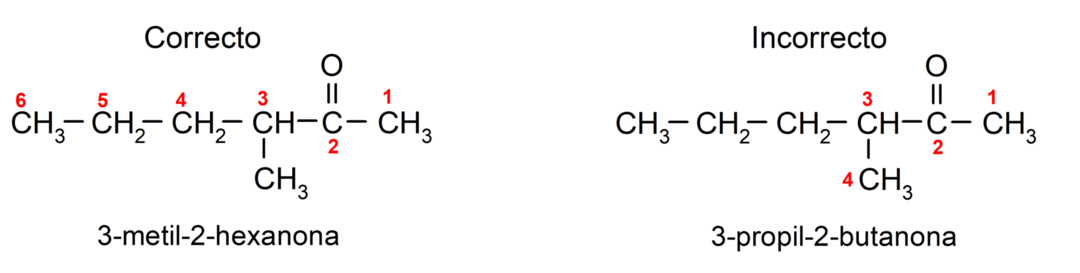
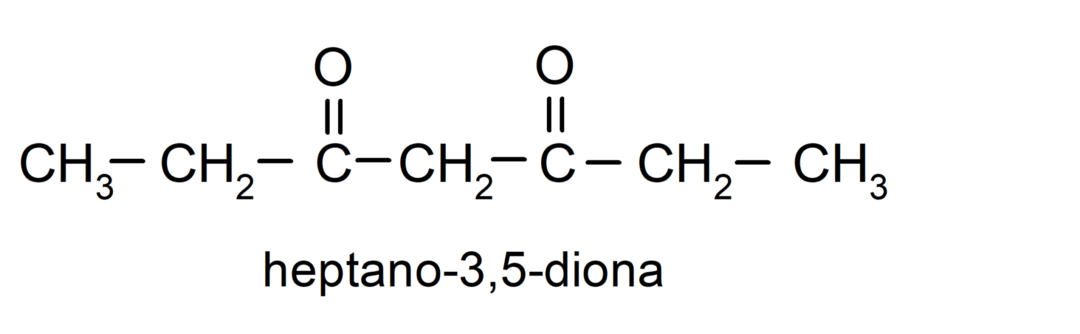
Es gibt Ketone, die zwei Carbonylgruppen haben, sie werden Dione genannt. Zum Beispiel:
Beispiele für Aldehyde
- Methanal (Formaldehyd)
- Ethanal (Acetaldehyd)
- Propanal (Propaldehyd)
- Butanal
- Pentanal
- Hexanal
- 3-Bromcyclopentancarbaldehyd
- Cyclohexancarbaldehyd
- Benzaldehyd
- 4,4-Dimethylpentanal
- 2-Hydroxybutanal
- 2-Hydroxy-2-methylbutanal
- 2,3-Dimethylpentanal
- Pentanial
- 4-Hydroxy-3-methoxybenzaldehyd
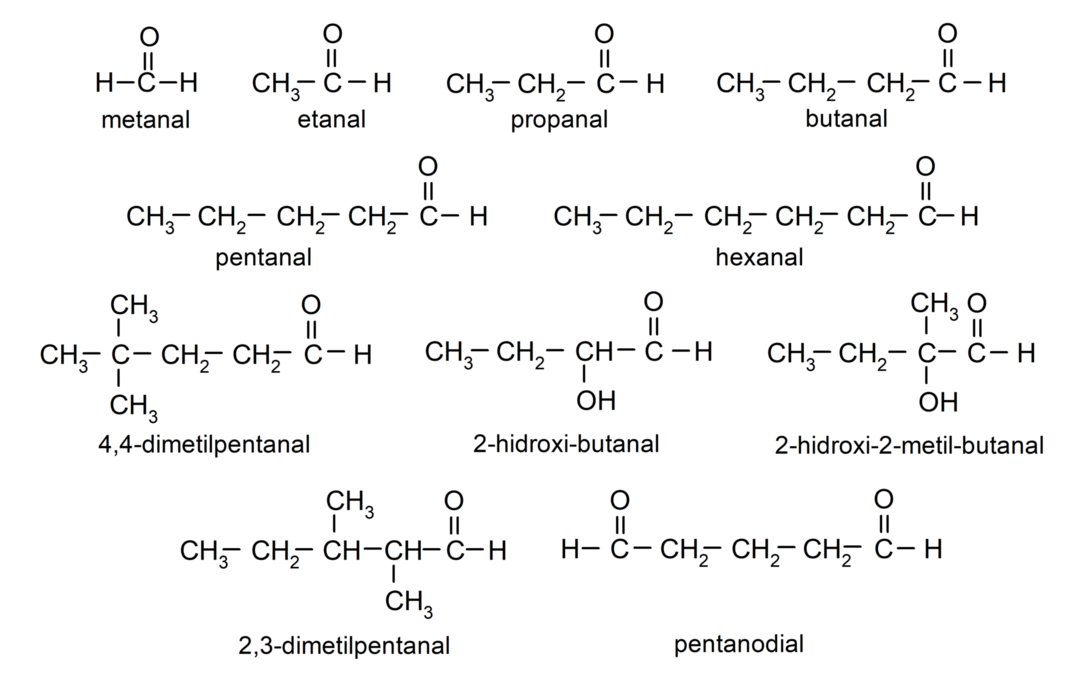
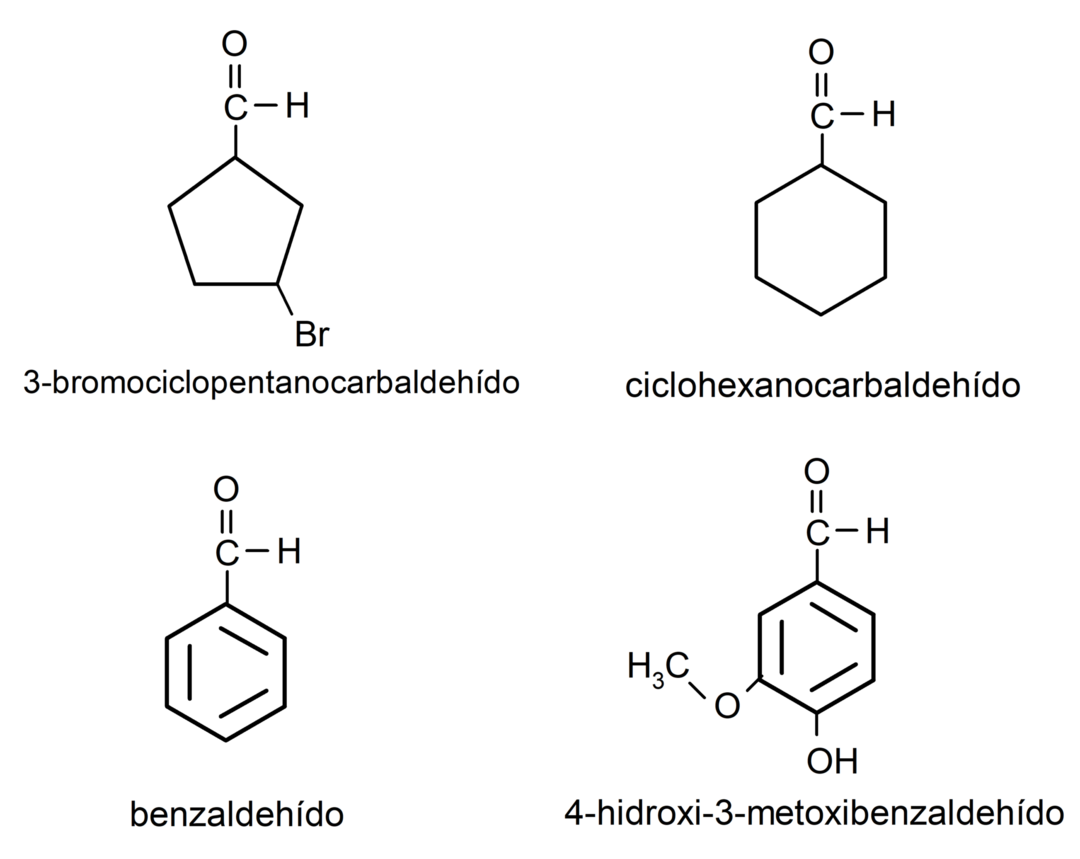
Beispiele für Ketone
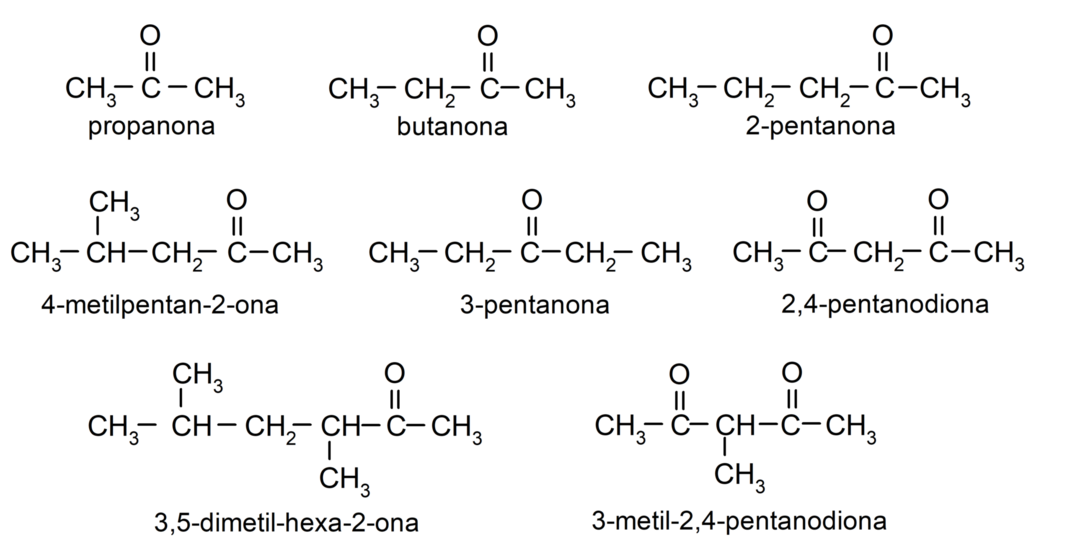
- Propanon (Aceton)
- Butanon
- 2-Pentanon
- 4-Methylpentan-2-on
- 3-Methylcyclohexanon
- Cyclohexylmethylketon
- 3,4-Dimethylhexan-2-on
- Ethylphenylketon
- 2,4-Pentandion
- Cyclohexanon
- 3-Pentanon
- 3-Methyl-2,4-pentandion
- 1-Phenylpropanon
- Cyclopentanon
- Diphenylketon
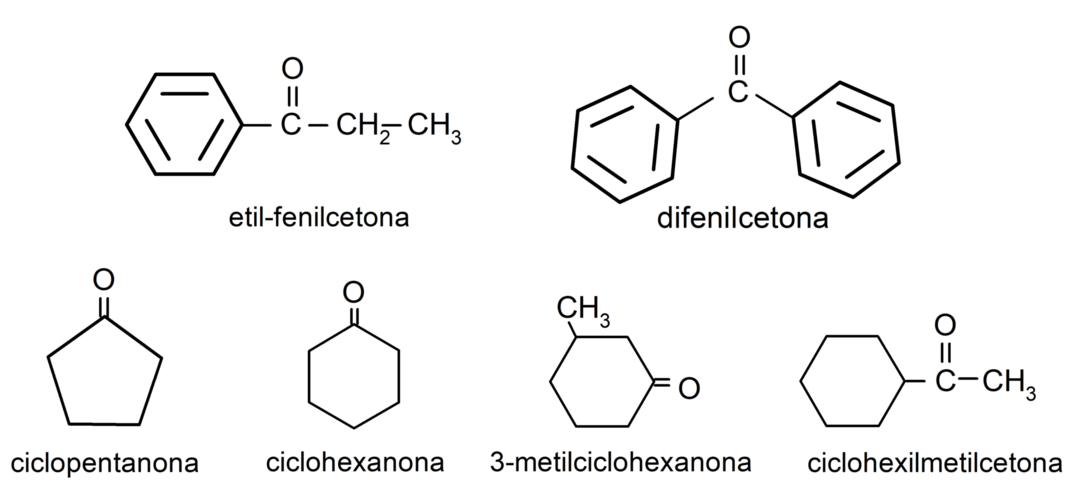
Verwendung von Aldehyden im Alltag
Einige Verwendungszwecke von Aldehyden sind:
- Sie werden zur Herstellung von Lösungsmitteln, Farben, Parfümen, Harzen und Essenzen verwendet.
- Sie werden als Konservierungsmittel in Kosmetikprodukten, biologischen Proben und Leichen verwendet. Für diese Zwecke wird am häufigsten Formaldehyd verwendet.
- Aus ihnen werden Kunststoffe hergestellt, die den Ersatz von Metallteilen in der Automobilindustrie ermöglichen.
- Sie werden als Aromastoffe für einige Lebensmittel verwendet.
- Sie werden als Desinfektionsmittel eingesetzt.
- Sie wurden zur Herstellung einiger Sprengstoffe verwendet, beispielsweise Pentaerythritoltetranitrat (TNPE).
Verwendung von Ketonen im täglichen Leben
Einige Verwendungszwecke von Ketonen sind:
- Sie werden bei der Herstellung von Lösungsmitteln verwendet. Insbesondere Aceton wird häufig zum Entfernen von Farben und Lacken verwendet.
- Sie werden bei der Herstellung einiger Kautschuke und Schmiermittel verwendet.
- Sie werden zur Herstellung von Farben, Lacken und Lacken verwendet.
- Sie werden zur Herstellung von Medikamenten und Kosmetika verwendet.
Aldehyd- und Ketontoxizität
- Die Aldehyde. Der Kontakt mit Aldehyden führt zu Reizungen der Haut, Augen und Atemwege. Darüber hinaus wurde die Exposition gegenüber Aldehyden mit Krankheiten wie Krebs, Kontaktdermatitis sowie Leber- und neurodegenerativen Erkrankungen in Verbindung gebracht. Formaldehyd beispielsweise wird von der WHO (Weltgesundheitsorganisation) als krebserregende Verbindung eingestuft.
- Ketone. Wiederholter Kontakt mit Ketonen kann zu Schäden am Zentralnervensystem führen. Dies kann zu Gedächtnisverlust, Schwäche, Muskelschmerzen und Krämpfen führen. Kommt die Haut außerdem mit Ketonen in Kontakt, kommt es zu Trockenheit und Rissen. Werden Ketone hingegen eingeatmet, kommt es zu Atemwegsreizungen und Husten.
Verweise
- Llorens Molina, JA. (2018). “Aldehyde und Ketone: Einige Beispiele.” http://hdl.handle.net/
- Gabriel Pinto Cañón, Manuela Martín Sánchez, José María Hernández Hernández, María Teresa Martín Sánchez (2015) „Das Tollens-Reagenz: von der Identifizierung von Aldehyden bis zu ihrer Verwendung in der Nanotechnologie. Historische Aspekte und didaktische Anwendungen.„Vol. 111 Nr. 3. Königlich Spanische Gesellschaft für Chemie.
- William Bauer, Jr. (2000) «Methacrylsäure und Derivate» in Ullmann’s Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- „Sie enthüllen einen neuen Toxizitätsmechanismus in einer Gruppe krebserregender Verbindungen, die aus der Ernährung und der Umwelt stammen“ (2022) In: www.conicet.gov.ar Verfügbar in: https://www.conicet.gov.ar/ Zugriff: 20. Juni 2023.
Folge mit:
- Alkohole
- Zucker
- Alkane
