Beispiel für chemische Elemente
Chemie / / July 04, 2021
Ein chemisches Element es ist eine reine Substanz, die aus Atomen des gleichen Typs besteht, wiederum gebildet durch eine Reihe von Protonen und Neutronen im Kern, und eine Menge von Elektronen in ihren Orbitalen. Einige werden auf natürliche Weise gefunden, andere durch Bildung der Moleküle einer Verbindung und andere wurden durch die Durchführung von Laborverfahren hergestellt. Alle chemischen Elemente bilden die Materie des gesamten Universums und erhalten die Existenz und das Funktionieren des menschlichen Körpers.
Jedes Element hat Eigenschaften und Verhaltensweisen, die es unterscheiden und einzigartig machen. aber gleichzeitig weist es Ähnlichkeiten mit einer Gruppe von Elementen in der Manifestation auf, die sie in der Universum. Aus diesem Grund gibt es das Periodensystem der chemischen Elemente, das diese Ähnlichkeiten anspricht, um die Elemente kohärent zu gruppieren und die Untersuchung ihrer Eigenschaften zu erleichtern.
Ordnungszahl eines Elements
Das Atom trägt im Kern eine Anzahl von Protonen, begleitet von ebenso vielen Neutronen
. Zu dieser Nummer es heißt Ordnungszahl, dargestellt als Z für wissenschaftliche Zwecke und in der Literatur. Für jedes Element ist diese Nummer eindeutig. Es gibt keine zwei Elemente mit derselben Ordnungszahl. Auch das Periodensystem orientiert sich an diesem Ordnungskriterium.Symbol eines Elements
In der Zeit der Alchemie, die etwa das Jahr 400 bis 1000 n. Chr. umfasst. C. zeichneten die Alchemisten ihre Experimente auf, die den Elementen Symbole zuordneten. Es waren einfache Symbole mit geometrischen Figuren, um das einzelne Element und die untersuchten Transformationen darzustellen.
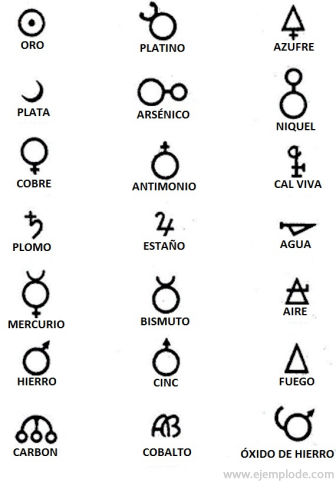
Einige Beispiele für alchemistische Symbole mit dem Namen des Elements oder der Verbindung, die sie repräsentierten.
In der Ära der modernen Chemie werden die Elemente noch mit Symbolen dargestellt, in diesem Fall Buchstaben, die auf ihren Namen in Latein oder Englisch verweisen.
Beispielsweise:
Das Symbol für Natrium ist N / A, nach seinem lateinischen Namen Natrium
Das Symbol des Goldes ist Au, nach seinem lateinischen Namen Aurum
Das Symbol für Silber ist Ag, nach seinem lateinischen Namen Argentum
Das Symbol für Kupfer ist Cu, nach seinem lateinischen Namen Cuprum
Das Symbol von Antimon ist Sb, nach seinem lateinischen Namen Stibium
Das Symbol des Eisens ist Vertrauen, nach seinem lateinischen Namen Ferrum
Das Symbol von Merkur ist Hg, nach seinem lateinischen Namen Hydrargyrum, was "flüssiges Silber" bedeutet
Das Symbol für Kalium ist K, nach seinem lateinischen Namen Kalium
Chemische Elementgruppen:
Das Periodensystem der chemischen Elemente unterteilt diese in Gruppen: Gruppen A und Gruppen B. Gruppen A sind acht, die die Elemente enthalten Alkalisch, das Alkalisch-Erdig, das Terreos, drei Familien von Elementen, deren Kopf den Namen der Familie definiert: Carbon-Familie, Stickstoff Familie, Familie Schwefel, das Halogene und der Edelgase. Gruppen B bestehen aus allen all Übergangsmetalle und die Seltenen Erden, die auch zwei große Familien sind: Lanthanoide Ja Aktiniden.
Gruppe IA: Alkalische Elemente:
Die Reihe der alkalischen Elemente besteht aus Wasserstoff (H), Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr). Sie haben alle eine elektronische Konfiguration, so dass sie in der letzten Schale ein Elektron haben. Ihren Namen verdanken sie der Tatsache, dass sie bei Kontakt mit Wasser zu Alkalien oder Hydroxiden reagieren. Es ist ein allgemeines Verhalten zwischen diesen Elementen. Je größer das Atom des Elements ist, desto reaktiver ist es, da die Kraft, mit der der Kern das Elektron aus der letzten Schale zurückhält, immer weniger Reichweite hat. Sie sind in der Lage, mit Halogenen ionische Bindungen zu bilden. Zum Beispiel: Die ionische Bindung, die reichlich vorhanden ist, ist die von Natrium-Chlor, die Natriumchlorid bildet NaCl.
Gruppe IIA: Erdalkalielemente:
Diese Elemente sind: Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra). Sie sind nicht freier Natur; stattdessen existieren seine Karbonate und Silikate in relativer Menge. Sie sind argentinisch weiß und kristallin. Sie verbinden sich leicht mit Sauerstoff, wenn sie der Luft ausgesetzt sind. Dies liegt zum Teil daran, dass sie in ihrer letzten Schale zwei Elektronen haben, was mit der Sauerstoffaufnahmekapazität übereinstimmt. Barium ist das aktivste Element der Gruppe und zusammen mit Calcium die mit den meisten industriellen Anwendungen in der Gruppe.
Gruppe IIIA: Erdelemente:
Gruppe IIIA umfasst die Elemente Bor (B), Aluminium (Al), Gallium (Ga), Indium (In) und Thallium (Tl). Bor ist ein nichtmetallisches Element, Aluminium ist amphoter (amphiprotisch), dh es kann als Säure und als Base wirken; und die anderen drei sind metallische Elemente. Sie haben drei Elektronen in ihrer letzten Schale, die eine Wertigkeit von +3 erzeugen, obwohl Gallium manchmal in einigen seiner Verbindungen mit einer Wertigkeit von +1 und +2 agiert. Bor ist das einzige Element in dieser Reihe, das Hydride bildet. Bor und Aluminium bilden Karbide.
Gruppe IVA: Carbon-Familie:
Die repräsentativen Elemente der Gruppe IVA sind Kohlenstoff (C), Silizium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb). Die ersten beiden sind in ihren Eigenschaften grundsätzlich nichtmetallisch, aber Germanium, Zinn und Blei sind metallisch, und zwar umso mehr, je höher ihre Ordnungszahl ist. Mit Ausnahme von Silizium hat jedes Element die Wertigkeiten +4 und +2.
Kohlenstoff und Silizium bilden Verbindungen, in denen Atome der Elemente durch Paare gemeinsamer Elektronen verbunden sind. Kohlenstoff ist die Essenz organischer Verbindungen, indem er sich mit Wasserstoff-, Sauerstoff-, Stickstoff-, Schwefel- und manchmal Siliziumatomen verbindet.
Silizium und Germanium werden zur Herstellung elektronischer Bauteile verwendet, da sie die Eigenschaft haben, sich wie Halbleiter zu verhalten.
Gruppe VA: Stickstoff Familie:
Gruppe VA umfasst die Elemente Stickstoff (N), Phosphor (P), Arsen (As), Antimon (Sb) und Wismut (Bi). Stickstoff und Phosphor sind nichtmetallisch, Arsen und Antimon sind Halbmetalle und Wismut ist ein Metall. Diese Elemente zeichnen sich durch die Bildung von Hydriden aus, von denen Ammoniak NH. am wenigsten giftig ist3. Stickstoff bildet Salpetersäure HNO3, zusammen mit Salzsäure in Agua Regia beteiligt, einer Mischung, die Edelmetalle wie Gold und Silber auflösen kann.
Stickstoff ist auch an zwei großen Gruppen organischer Verbindungen, den Aminen und Amiden, beteiligt, die als Derivate von Ammoniak NH. angesehen werden können3, durch Substitution eines Wasserstoffs durch eine Kohlenwasserstoffkette.
Gruppe VIA: Sauerstofffamilie:
Bestehend aus den Elementen Sauerstoff (O), Schwefel (S), Selen (Se), Tellur (Te) und Polonium (Po). Sauerstoff ist am aktivsten und hat die Fähigkeit, leicht kovalente Bindungen zu bilden. Bei Kontakt mit Metallen in einer Umgebung mit hoher Luftfeuchtigkeit bildet es Oxide. Es bildet ein Resonanzmolekül namens Ozon, das den Planeten vor UV-Strahlung schützt.
Gruppe VIIA: Halogene:
Sein Name bedeutet "Verkaufsformer". Die Gruppe besteht aus den Elementen Fluor (F), Chlor (Cl), Brom (Br), Jod (I) und Astat (At). Sie haben sieben Elektronen in der letzten Schale, wodurch sie Rezeptoren für ein Elektron sein können. Diese Eigenschaft führt dazu, dass sie sich mit den Elementen der Gruppe IA verbinden und binäre Salze bilden. Fluor zeichnet sich durch die größte Elektronegativität des gesamten Periodensystems mit einem Wert von 4,0 aus, sein Gegenstück ist Cäsium, mit Elektronegativität von 0,7. Diese Eigenschaft verleiht ihm die Stärke, andere Atome anzuziehen und vorrangig eine Bindung zu bilden mit Sie.
Gruppe VIIIA: Edelgase:
Auch Gruppe der Inertgase genannt, wird es von den Elementen Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und Radon (Ra) gebildet. Sie sind die Elemente, die alle ihre vollständige elektronische Konfiguration aufweisen und daher unter normalen Bedingungen nicht in der Lage sind, zu reagieren. Sie werden hauptsächlich für leuchtende Handelsschilder verwendet, die sichtbares Licht emittieren, wenn ein elektrischer Strom auf sie einfällt.
Gruppen B: Übergangsmetalle:
In zehn Gruppen zu je drei Elementen sind die Übergangsmetalle gruppiert. Dazu gehören die besten elektrischen Leiter: Silber (Ag), Kupfer (Cu), Gold (Au); die besten Bauteile für Städtebau und Ingenieurwesen; Eisen (Fe), Titan (Ti), Aluminium (Al), Zirkonium (Zr), Wolfram (W); die besten Katalysatorkomponenten: Nickel (Ni), Vanadium (V), Platin (Pt); und die Hauptbestandteile der Beschichtung: Cadmium (Cd), Chrom (Cr), Zink (Zn). Sie handhaben normalerweise Wertigkeiten zwischen +1 und +3, aber Elemente wie Chromium handhaben die Wertigkeiten +2, +3, +6.
Seltene Erden: Lanthanide und Actiniden:
Sie werden seltene Erden wegen ihrer Seltenheit auf dem Planeten genannt. Sie bestehen aus zwei Gruppen: Lanthaniden und Aktiniden. Sie befinden sich auf den beiden separaten Zeilen des Periodensystems. Sie arbeiten im Allgemeinen mit einer Wertigkeit von +3 und neigen dazu, Hydroxide zu bilden. Das wichtigste Element unter ihnen ist Cer, das bei der Herstellung von pyrophoren Legierungen (Alloy Mischmetall, für leichtere Steine), in Gasschläuchen zur Beleuchtung und bei der Herstellung von Spezialgläsern, die ultraviolette Strahlen und Wärmestrahlung absorbieren.
Zu diesen Gruppen gehören die stärksten radioaktiven Elemente wie Uran (U) und Plutonium (Pu). die aufgrund ihrer Instabilität Energie freisetzen und zerfallen, dabei Alpha-Teilchen verlieren (Kerne von Helium). Später werden sie laut der radioaktiven Reihe weniger instabile Elemente.



