10 Παραδείγματα μιγμάτων αερίου
Miscellanea / / July 04, 2021
Μείγματα από αέριες ουσίες Είναι μερικές από τις ευκολότερες που επιτυγχάνονται, καθώς είναι πολύ πιθανό να αναμιχθούν ουσίες που βρίσκονται σε αυτήν την κατάσταση συσσωμάτωσης. Για παράδειγμα: Μείγμα νέον, αργού και ξένου, εντομοκτόνο αερολύματος, αέρα και ήλιο.
Πρακτικά όλα τα αέρια μπορούν να συνδυαστούν απεριόριστα, φυσικά ρυθμίζονται από ορισμένα χημικά, φυσικά και ουσιαστικά σχετίζονται με πτυχές ασφάλειας των χρηστών που χειραγωγεί. Όπως και οι διαφορετικοί τύποι μιγμάτων που δημιουργούνται μεταξύ των ουσιών, τα μείγματα του αέρια έχουν επίσης ιδιότητες που είναι μοναδικές σε αυτές.
Η μελέτη του αφρώδη μίγματα είναι συνήθως τόσο χρήσιμη όσο και των αερίων στην καθαρή τους κατάσταση: η ίδια γνώση για τον αέρα που υπάρχει μέσα η ατμόσφαιρα θα ήταν αδύνατη αν δεν ήταν για τη γνώση σχετικά με τις αναλογίες και τις συμπεριφορές των μικτών αερίων.
Με αυτόν τον τρόπο, είναι σημαντικό να γνωρίζουμε μερικά χαρακτηριστικά μιγμάτων αερίων, όπως η ιδιότητα μερικής πίεσης (που ασκείται από καθένα από τα αέρια εντός του μείγμα) και εκείνο του γραμμομοριακού κλάσματος (αναλογία μεταξύ του αριθμού γραμμομορίων αερίου συστατικού με εκείνη του συνολικού μείγματος σόδα). Τα γραμμομόρια εκφράζουν την ποσότητα αερίου στο μείγμα.
ο Ο νόμος του Ντάλτον δηλώνει ότι η συνολική πίεση ενός μείγματος αερίου είναι ίση με το άθροισμα των μερικών πιέσεων του καθενός ένα από τα μεμονωμένα αέρια που συμμετέχουν σε αυτό (αυτό υπόκειται στα αέρια που δεν αντιδρούν μεταξύ τους Ναί). Η μερική πίεση εννοείται εδώ ως αυτή που θα ασκούσε καθένα από τα αέρια εάν βρέθηκε μόνο στο ίδιο δοχείο και υπό τις ίδιες συνθήκες θερμοκρασία. Α) Ναι:
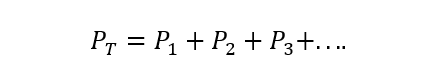
Οπου ΠΤ είναι η συνολική πίεση και P1, Π2 Και π3 είναι οι μερικές πιέσεις των υποθετικών αερίων 1, 2 και 3 στο μείγμα αερίων.
Χρησιμοποιώντας τον νόμο του Dalton, αναπτύχθηκε μια έκφραση για τον υπολογισμό του μερική πίεση ενός αερίου σε αέριο μείγμα εάν γνωρίζουμε τη συνολική του πίεση και το γραμμομοριακό κλάσμα του.
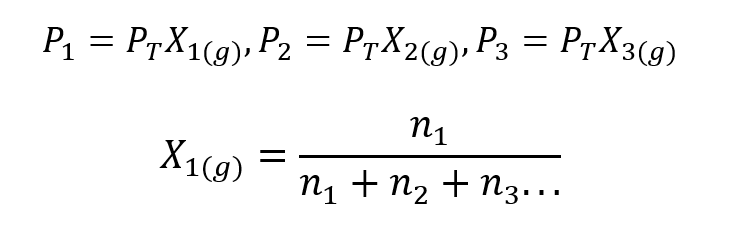
Οπου Χ1, Χ2 Γ Χ3 είναι τα γραμμομοριακά κλάσματα των υποθετικών αερίων 1, 2 και 3 στο μείγμα αερίων, και ν1, ν2 Γ ν3 είναι οι ποσότητες ουσίας καθενός από αυτά τα αέρια στο ίδιο μείγμα.
Ενα από κύριες ιδιότητες των συστατικών σε μείγματα είναι η συγκέντρωση, η οποία μπορεί να εκφραστεί σε διαφορετικές μονάδες. Στην περίπτωση μειγμάτων αερίων, η συγκέντρωση των συστατικών του μπορεί να εκφραστεί σε ppm (μέρη ανά εκατομμύριο), μια μονάδα που αναφέρεται στον όγκο της. Δηλαδή, μια ορισμένη ποσότητα ppm ενός συστατικού σε ένα μείγμα αερίων είναι η αναλογία του όγκου αυτής της συγκεκριμένης ποσότητας προς τον όγκο κάθε εκατομμυρίου μονάδων μίγματος.
Είναι σημαντικό να σημειωθεί ότι ppm ενός αερίου εξαρτάται από τη θερμοκρασία και την πίεση του αερίου. Για το λόγο αυτό, για τον υπολογισμό του ppm ενός αερίου, χρησιμοποιούνται συνήθως κανονικές συνθήκες πίεσης και θερμοκρασίας. (CNPT), που δίνουν μια φυσιολογική κατάσταση σε 0 βαθμούς Κελσίου θερμοκρασίας, και 1013 εκτοπασκάλ (1 bar) Πίεση. Εάν αυτές οι συνθήκες δεν χρησιμοποιούνται, πρέπει να καθορίσετε ποιες θα χρησιμοποιηθούν.
Μπορεί να σας εξυπηρετήσει:
Παραδείγματα μιγμάτων αερίων
Η ακόλουθη λίστα περιέχει μείγματα αερίων, προσδιορίζοντας τα στοιχεία που εμφανίζονται στο μείγμα:
- Αέρας (μείγμα 21% οξυγόνου και 79% αζώτου, συν άλλα αέρια σε μικρές αναλογίες)
- Cronigón (μείγμα αργού 99% και οξυγόνου 1%)
- Trimix (μείγμα οξυγόνου, αζώτου και ηλίου)
- Μίγμα νέον, αργού και ξένου
- Μίγμα 85% μεθανίου, 9% αιθανίου, 4% προπανίου και 2% βουτανίου.
- Εξαφθοριούχο θείο και αέρας
- Εντομοκτόνο αερολύματος
- Αέρας και ήλιο
- Nitrox (μείγμα αέρα, εμπλουτισμένο με οξυγόνο και άζωτο)
Ακολουθήστε με:


