Παραδείγματα Ενδόθερμων Αντιδράσεων
Παραδείγματα / / November 09, 2023
ΕΝΑ ενδόθερμη αντίδραση Είναι μια αντίδραση που απορροφά ενέργεια από το μέσο με τη μορφή θερμότητας. Σε αυτές τις αντιδράσεις, για να μετατραπούν τα αντιδρώντα σε προϊόντα, είναι απαραίτητο να απορροφήσουν θερμότητα, γεγονός που προκαλεί τα προϊόντα να έχουν μεγαλύτερη ενέργεια από τα αντιδρώντα που τα προκάλεσαν. Μερικά παραδείγματα ενδόθερμων αντιδράσεων είναι: φωτοσύνθεση και ηλεκτρόλυση νερού.
- Δείτε επίσης: Χημικές αντιδράσεις
Παραδείγματα ενδόθερμων αντιδράσεων στην καθημερινή ζωή
Μερικές από τις κύριες ενδόθερμες αντιδράσεις είναι:
Παραγωγή όζοντος στην ατμόσφαιρα. Το όζον παράγεται στην ατμόσφαιρα όταν το μοριακό οξυγόνο (Ο2) απορροφά την υπεριώδη ακτινοβολία και διασπάται. Τότε ένα άτομο οξυγόνου (Ο) μπορεί να αλληλεπιδράσει με ένα άλλο μόριο οξυγόνου (Ο2) και σχηματίζουν όζον (Ο3).

Ηλεκτρόλυση νερού. Είναι η διαδικασία με την οποία εφαρμόζεται ηλεκτρική ενέργεια στο νερό για να το χωρίσει στα δύο συστατικά του, το υδρογόνο (Η) και το οξυγόνο (Ο).
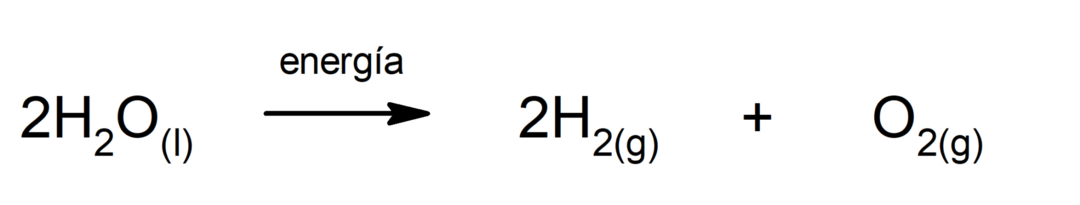
Φωτοσύνθεση. Είναι η χημική αντίδραση με την οποία, απορροφώντας
ηλιακή ενέργεια, διοξείδιο του άνθρακα (CO2) μετατρέπεται σε γλυκόζη. Αυτή η αντίδραση αποτελεί την κύρια οδό διατροφής των φυτών.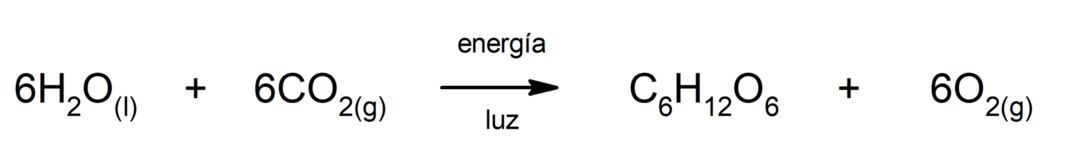
Παραγωγή θειούχου σιδήρου (II).. Για να συμβεί η αντίδραση μεταξύ θείου και σιδήρου, είναι απαραίτητο να παρέχεται ενέργεια με τη μορφή θερμότητας.
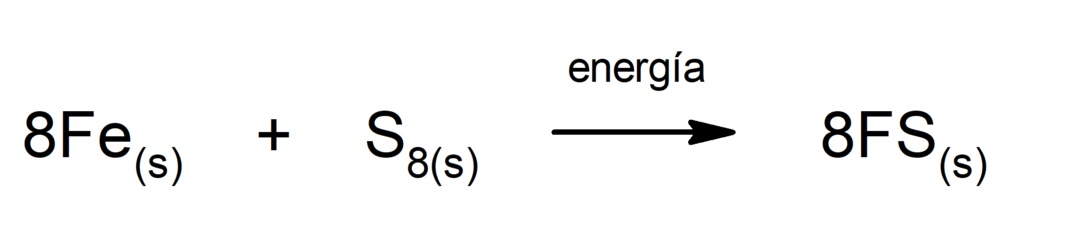
Αποσύνθεση διοξειδίου του άνθρακα (CO2). Η αποσύνθεση του CO2 Σε υψηλές θερμοκρασίες παράγει μονοξείδιο του άνθρακα (CO) και οξυγόνο (Ο2).
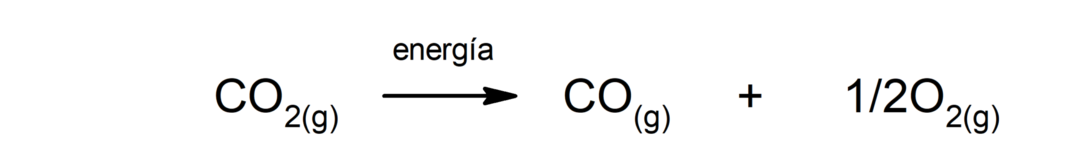
Αποσύνθεση ανθρακικού ασβεστίου (CaCO3). Το ανθρακικό ασβέστιο αποσυντίθεται με την απορρόφηση της θερμότητας και παράγει οξείδιο του ασβεστίου (CaO) και διοξείδιο του άνθρακα (CO2).
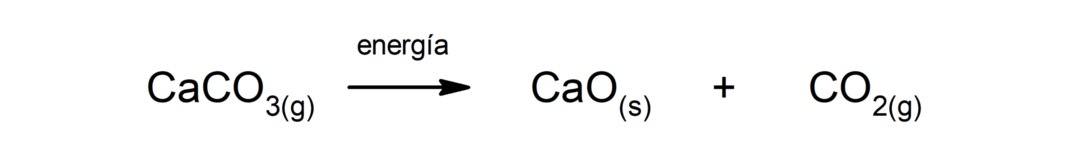
Διαφορά μεταξύ ενδόθερμης και εξώθερμης αντίδρασης
Η κύρια διαφορά μεταξύ ενδόθερμων και εξώθερμων αντιδράσεων είναι ότι οι ενδόθερμες αντιδράσεις απορροφούν θερμότητα, ενώ οι εξώθερμες αντιδράσεις απελευθερώνουν θερμότητα.
Επιπλέον, οι ενδόθερμες αντιδράσεις χαρακτηρίζονται από αύξηση της ενθαλπίας, ενώ οι εξώθερμες αντιδράσεις συνδέονται με μείωση της ενθαλπίας.
Η ενθαλπία είναι ένα θερμοδυναμικό μέγεθος που ορίζει τη ροή της θερμικής ενέργειας σε σταθερή πίεση κατά τη διάρκεια μιας χημικής αντίδρασης. Αντιπροσωπεύεται από το γράμμα Η και η παραλλαγή του είναι ένας από τους κύριους δείκτες για να καθοριστεί εάν μια χημική αντίδραση είναι ενδόθερμη ή εξώθερμη.
- Εάν μια χημική αντίδραση έχει μεταβολή ενθαλπίας μεγαλύτερη από μηδέν (ΔH > 0) είναι ενδόθερμος.
- Εάν μια χημική αντίδραση έχει μεταβολή ενθαλπίας μικρότερη από μηδέν (ΔH < 0) είναι εξώθερμος.
Ακολουθήστε με:
- Φυσικοχημικά φαινόμενα
- Η χημεία στην καθημερινή ζωή
- Η χημεία στην καθημερινή ζωή
- Οργανική και ανόργανη χημεία
βιβλιογραφικές αναφορές
- Soto-Córdoba, S. (2016). Ενδόθερμες Αντιδράσεις. Αποθετήριο Τεχνολογίας Τεχνολογικό Ινστιτούτο Κόστα Ρίκα.
- Κορομίνας, Τζ. (2017). Χημικές αντιδράσεις της καθημερινής ζωής. Άλεμπιτς, (90), 8-26.
- Σάντσεθ, Μ. Τ. M., & Sánchez, M. Μ. (2002). Πειραματική μελέτη ενδόθερμων αντιδράσεων για μαθητές ESO. Annals of Chemistry of the RSEQ, (4), 36-39.



