Orgaaniliste ja anorgaaniliste molekulide näide
Keemia / / November 13, 2021
The Üldkeemia see on teadus, mis uurib igat tüüpi mateeriaid, mis on olemasja nende sisemised muutused millel on selle eri tüüpide vahel kontakt.
The Orgaaniline keemia See on üldkeemia osa, mille eesmärk on uurida küsimust, mille peamine koostisosa on Süsinikelement, Mis siis see on osa elusorganismidest.
The Anorgaaniline keemia See on üldkeemia osa, mis vastutab nn "mineraalne aine", mis on osa Ma ei ela keskkonda.
The Molekul on liit erinevate elementide erinevad aatomid kemikaalid uute ainete moodustamiseks nende eriliste omadustega.
Üldkeemias Elemendid Kas on puhtad ained mis on moodustatud ühte tüüpi aatomid. Elemendid on klassifitseeritud keemiliste elementide perioodilisustabelis.
Täpselt nagu tema Aatom on Elementide põhiüksus, Molekul on ühendite põhiühik, mis on ained, millel on iseloomulik keemiline käitumine.
The Ühendid võivad tekkida selle tagajärjel looduslik fenomenvõi luua laborites või sisse Tööstusettevõtted, nii et molekule on kõikjal. Molekulid on mineraalides, puulehtedes, toidus, ravimites, joogivees, hingatavas õhus ja isegi keskkonna saastuses.
Üldkeemia jaguneb peamiselt Anorgaaniline keemia Y Keemilinekuni Orgnica, nii et molekule saab liigitada ka anorgaanilisteks ja orgaanilisteks.
Anorgaanilised molekulid
Anorgaanilises keemias moodustavad molekulid enamasti positiivsete valentside aatomite kombinatsioon teiste negatiivsete valentsidega aatomites. Need sidemed moodustuvad peamiselt aatomite vahelistest elektromagnetilistest jõududest, mis tekivad valentselektronide olemasolul.
Seega tekivad kõik ioonsed ühendid, nagu soolad, oksisoolad, happed, oksihapped, oksiidid ja hüdroksiidid.
Anorgaanilised molekulid elektrolüütidena
Ioonmolekulide peamine omadus on see, et kui nad puutuvad kokku veega H2VÕI need on jagatud selle kaheks osaks: positiivseks ja negatiivseks. Need kaks osa, elektriliselt laetud aatomid või aatomirühmad, on vees hajutatud. Anorgaanilisele ainele, mis on võimeline vees eralduma, seda nimetatakse elektrolüüdiks.
Vee ning positiivselt ja negatiivselt laetud osakeste poolt moodustatavat lahust nimetatakse "Elektrolüütiline lahus". Seda tüüpi lahusel on võime juhtida elektrivoolusid, mistõttu seda kasutatakse elektrokeemilistes rakkudes, näiteks autoakudes.
Anorgaanilised happed ja leeliselised molekulid
Anorgaaniliste molekulide puhul nagu Happed, Oksühapped ja Hüdroksiidid, samal ajal kui nad eralduvad positiivseks ja negatiivseks osaks, annavad nad lahusele omaduse, mida nimetatakse vesinikupotentsiaaliks, mõõdetuna vesinikioonide kontsentratsiooni negatiivne logaritm.
The Vesiniku potentsiaal (pH) määrab, kui palju lahus on happeline. PH-skaalal, mis ulatub maksimaalse happesuse väärtusest 1 kuni 14-ni, mis on täielik leeliselisus või aluselisus, on happe iseloom vahemikus 1 kuni 6 ja leeliseline on vahemikus 8 kuni 14. 7 tähistab neutraalset pH-d; ei happeline ega aluseline. H + kontsentratsiooni negatiivse logaritmi tulemus annab meile teada, kus me skaalal oleme.
Hapete näited:
Vesinikkloriidhape: HCl: H+ + Cl-
Vesinikbromiidhape: HBr: H+ + Br-
Väävelhape: H2S: 2H+ + S-2
Tsüanhappe hape: HCN: H+ + CN-
Vesinikkloriidhape: HI: H+ + I-
Oksühapete näited:
Väävelhape: H2SW4: 2H+ + NII4-2
Süsinikhape: H2CO3: 2H+ + CO3-2
Lämmastikhape: HNO3: H+ + EI3-
Fosforhape: H3PO43H+ + PO4-3
Perkloorhape: HClO4: H+ + ClO4-
Hüdroksiidide näited:
Naatriumhüdroksiid: NaOH: Na+ + OH-
Kaltsiumhüdroksiid: Ca (OH)2: Ca+ + 2OH-
Ammooniumhüdroksiid: NH4OH: NH4+ + OH-
Kaaliumhüdroksiid: KOH: K+ + OH-
Magneesiumhüdroksiid: Mg (OH)2: Mg+ + 2OH-
Anorgaanilised molekulid keemilistes reaktsioonides
Kui anorgaanilised molekulid osalevad keemilises reaktsioonis, võib olla neli põhilist ja lihtsat reaktsioonimehhanismi: Süntees, lagunemine, lihtne asendamine ja kahekordne asendamine. Siin on näide neist:
Süntees
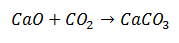
Sünteesireaktsioon on selline, milles kaks molekuli saavad kokku ühest molekulist koosneva lõpptoote. Selles näites on tegemist kaltsiumoksiidi ühendamisega süsinikdioksiidiga, moodustades kaltsiumkarbonaadi molekuli.
Lagunemine:

Lagunemisreaktsioon on selline, milles algmolekul eraldub kaheks uueks stabiilseks molekuliks. Nii on kaltsiumhüdroksiid, mis eraldub kaltsiumoksiidi molekuliks ja teiseks veeks.
Lihtne asendamine:

Lihtsas asendusreaktsioonis elemendi aatom vahetatakse molekuli ühe aatomiga. Nii on metallilise tsingi puhul, asetades end vesinikkloriidis oleva vesiniku asemele, vabastades selle ja moodustades tsinkkloriidi molekulid.
Topelt asendamine:
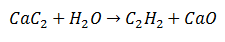
Topeltasendusreaktsioonis kahe algmolekuli teatud aatomid vahetatakse, et saada produktidena kaks erinevat molekuli. Nii on kaltsiumkarbiidi puhul, mis vabastab süsiniku, mis ühendub vees oleva vesinikuga, moodustades atsetüleeni. Kaltsium seondub hapnikuga, moodustades teise tootena kaltsiumoksiidi.
Orgaanilised molekulid
Orgaaniline keemia on süsinikkeemia, mis tähendab, et kõigis orgaanilistes molekulides on seda elementi erinevates struktuurilistes paigutustes.
Orgaanilisi molekule iseloomustab kovalentsete sidemete pidev olemasolu. Kovalentsed sidemed nendega, milles kaks aatomit ühinevad, et jagada oma valentselektrone ja täiendada oma oktette vastastikku.
See kehtib süsiniku kohta, mis seondub sama elemendi teiste aatomitega. Moodustuvad väga erineva pikkusega ahelad, alates kahest kuni kuuekümnest süsinikuaatomist, ja isegi need ahelad nad hargnevad teiste sama pikkusega ahelatega, saavutades tohutu molekulide mitmekesisuse orgaaniline.
Samuti on olemas ioonsidemed, kuid need esinevad pikkade reaktsioonimehhanismide vaheetappides, milles moodustub soovitud molekul.
Lihtsaimad orgaanilised molekulid hõlmavad süsinikku ja vesinikku. Viimane lõpetab süsinikvalentsi, mis seda nõuab.
Orgaanilises keemias võivad molekulid olla lineaarsed või alifaatsed, hargnenud, tsüklilised ja aromaatsed.
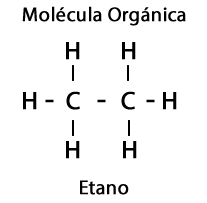
Lisaks osalevad orgaanilistes molekulides elemendid hapnik, lämmastik, väävel ja fosfor, mis tekitab molekulide jaoks muljetavaldava funktsionaalrühmade mitmekesisuse.
Orgaaniliste molekulide funktsionaalsed rühmad
The Funktsionaalsed rühmad on kahe või enama aatomi rühmad, mis süsinik-vesiniku ahelaga liitumisel moodustavad konkreetse käitumisega erinevaid keemilisi liike. Järgmisena on loetletud seitse orgaaniliste molekulide tüüpi koos vastavate funktsionaalsete rühmadega. Tähte "R" kasutatakse süsinik-vesiniku ahela tähistamiseks.
Alküülhalogeniidid - vorm: R-X / funktsionaalrühm: halogeenelement (kloor, broom, jood)

Alkoholid - Vorm: R-OH / Funktsionaalne rühm: -OH või hüdroksüül.
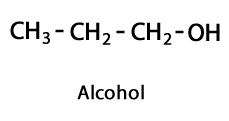
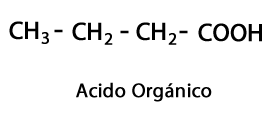
Aldehüüdid - Vorm: R-CHO / Funktsionaalne rühm: -CHO, mis läheb alati ahela lõppu.
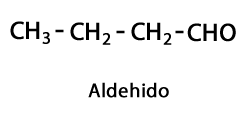
Ketoonid - Vorm: R-CO-R / Funktsionaalne rühm: -CO- või karboksü, alati keti keskel.
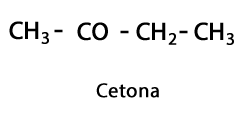
Orgaanilised happed - Vorm: R-COOH / Funktsionaalne rühm: -COOH või karboksüül, alati ahela lõpus.
Happeestrid - Vorm: R-COO-R / Funktsionaalne rühm: -COO- on happe-ahela ühendamise tulemus teise süsinik-vesiniku ahelaga.
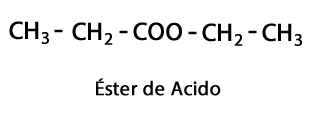
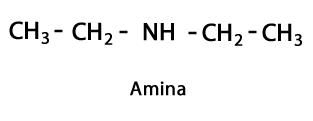
Aminid - Vorm: R-NH2, R-NH-R, R-N-2R / funktsionaalne rühm: -NH2, -NH-, -N = või aminorühm, mis on vesinikuga täiendatud lämmastik nendes kohtades, kus süsinik-vesinikahelat pole. Nagu öeldud, võib see minna keti otsa või keskele. Lämmastikuaatomiga võib lõppmolekuli moodustamiseks olla kaasas üks, kaks või kolm orgaanilist ahelat. Amiine võib pidada ammoniaagi NH orgaanilisteks derivaatideks3.
Orgaanilised molekulid keemilistes reaktsioonides
Orgaanilised molekulid, mida pikemad on nende süsinik-vesiniku ahelad, seda rohkem saite või aatomeid on keemilises reaktsioonis osalemiseks saadaval.
Kõige sagedamini lisatakse elemendid või ahelad ühele olemasolevatest süsinikest või eraldatakse osa peaahelast, et tekiks teistsugune orgaaniline ühend.
Kuna sellised reaktsioonid on aeglased, kasutatakse katalüsaatoreid, mis on reaktsioonide kiirendamiseks keemilised ained. Mõnel juhul on katalüsaator platinummetallist peenvõrk.
Anorgaaniliste molekulide näited
Naatriumkloriid NaCl
Kaaliumkloriid KCl
Ammooniumkloriid NH4Cl
Naatriumnitraat NaNO3
Kaaliumnitraat KNO3
Ammooniumnitraat NH4MITTE3
Väävelhape H2SW4
Fosforhape H3PO4
Fosforhape H3PO3
Vesinikkloriidhappe HCl
Joodhape HI
Naatriumhüdroksiid NaOH
Kaaliumhüdroksiid KOH
Ammooniumhüdroksiid NH4Oh
Kaltsiumhüdroksiid Ca (OH)2
Magneesiumhüdroksiid Mg (OH)2
Raudhüdroksiid Fe (OH)2
Raudhüdroksiid Fe (OH)3
Raudsulfiid FeS
Raudsulfaat FeSO4
Raudsulfaat Fe2(SW4)3
Orgaaniliste molekulide näited
Glükoos C6H12VÕI6
Metaan CH4
Etaan C2H6
Atsetüleen C2H2
Propaan C3H8
Butaan C4H10
Etanool C2H6VÕI
Sahharoos C12H22VÕI11
Metanool CH4VÕI
Glütserool C3H8VÕI3
