Oktetireegli definitsioon
Miscellanea / / November 29, 2021
Kontseptuaalne määratlus
Okteti reegel on teooria, mis selgitab tabeli elementide käitumist Perioodilised, mis püüavad stabiliseerida, täites oma viimase taseme kaheksa elektroniga energiline. Elementide keemia mõistmise aluspõhimõte on teadlane Lewis aastatel 1916–1917.

Keemiainsener
Kui vaatame viimast rühma Perioodilisustabel, millised rühmad gaasid üllas, näeme, et neil on viimane täielik tase kaheksa valentselektroniga, mis annab neile teatud stabiilsuse ja võime käituma inertsete gaasidena, kuna nad ei reageeri keemiliselt teiste keemiliste ainetega... miks? Sest nad ei kipu valentselektrone juurde saama ega kaotama. See võimaldas selgitada teiste perioodilise tabeli elementide käitumist, mis võidavad, kaotavad või jagavad elektrone. Pärast keemilist stabiliseerimist lähima väärisgaasi elektronide konfiguratsiooni saavutamine, kaheksa valentselektroni valmimine.
Nagu kõigel looduses, on ka reeglist erandeid. On elemente, mis saavutavad teatud stabiilsuse ja madalama oleku
Energia mille viimasel tasemel on rohkem või vähem kui kaheksa elektroni. Alustades perioodilisuse tabeli esimesest elemendist vesinikust (H), mis on stabiliseeritud kahe elektroniga, kuna sellel on üks aatomiorbitaal. Muud juhtumid on: berüllium (Be), boor (Bo), mis stabiliseerub vastavalt nelja ja kuue elektroniga, või väävel (S), mis on võib stabiliseerida kaheksa, kümne või kaheteistkümne valentselektroniga tänu võimalusele lisada selle konfiguratsiooni "d" orbitaal elektroonika. Veel võib mainida heeliumi (He), fosforit (P), seleeni (Se) ja räni (Si). Pange tähele, et heelium (He) on ainus väärisgaas, millel on ainult kaks valentselektroni.Oktetireegli näited ioonse, kovalentse ja metallilise sideme puhul
Kui aatom kaotab, võidab või jagab elektrone, tekivad erinevad sidemed, millest tekivad uued ühendid. Üldiselt võime need sidemed rühmitada kolme põhivarianti: ioonside, kovalentne või metalliline side.
Kui element kaotab või kogub elektrone enda stabiliseerimiseks, kandes täielikult üle oma valentselektronid, nimetatakse ioonseks sidemeks, samas kui elektrone jagavad mängus olevad liigid, nimetatakse seda sidemeks kovalentne. Lõpuks, kui mängus olevad elemendid on metallid, mille katioonid on ühendatud elektronide merre, on side metalliline. Igal seda tüüpi ametiühingutel on teatud omadused, kuid neil on ühine tunnus Tavaliselt toimub elektronide interaktsioon stabiilsuse ja madalaima energia otsimisel reegli täitmiseks Oktett.
Vaatame iga liigendit üksikasjalikumalt. Kovalentse sideme puhul annab selle elektronide jagamise võimalus, see toimub üldjuhul mittemetallilised elemendid nagu: Cl2 (molekulaarkloor) või CO2 (süsinikdioksiid) ja isegi H2O (Vesi). Molekulidevahelised jõud, mis neid ristmikke juhivad, on põhjus teisest jaotisest.
Metalliühenduste puhul mainime, et see esineb metallide vahel, näiteks vase (Cu), alumiiniumi (Al) või tina (Sn) puhul. Kuna metallid kalduvad loovutama oma elektrone enda stabiliseerimiseks, moodustavad nad laetud liike, mida nimetatakse katioonid (positiivsete laengutega), moodustavad need suurde elektronipilve sukeldatud ioonid ühendeid metallist. Elektronid võivad selles struktuuris vabalt hajuda. Jõud, mis neid koos hoiavad, on metallilised jõud, mis annavad sellele teatud omadused, näiteks kõrge juhtivuse.
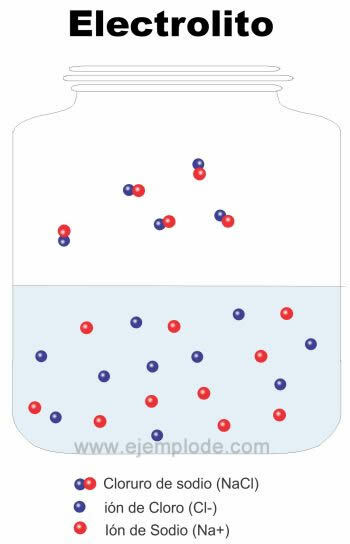
Ioonset sidet iseloomustavad jõud atraktsioon seda moodustavate väga intensiivsete elementide vahel, mida nimetatakse elektrostaatilisteks jõududeks, ja see on nii sellepärast, nagu nägime, kasu saada ja elektronide netoülekanne elementide vahel, mis moodustavad laetud liike, ioone. Üldjuhul on tegemist metallilise ja mittemetallilise elemendi moodustatud liidud, mille elektronegatiivsuse erinevus on nii suur, et võimaldab valentselektronide loovutamist. Tavaliselt mine välja Need on ioonsed ühendid nagu: NaCl (naatriumkloriid, lauasool) ja LiBr (liitiumbromiid).
Nende kolme sideme olemasolu seletatakse üleminekuna seda moodustavate ühendite elektronegatiivsuse mõttes. Kui elektronegatiivsuse erinevus on väga suur, kipuvad elemendid moodustama ioonseid sidemeid, samas kui Sarnase elektronegatiivsusega elemendid kipuvad jagama sideelektrone ja on tüüpsidemed kovalentne. Kui elementide elektronegatiivsuse erinevust (näiteks Br2) pole, on side mittepolaarne kovalentne. et elektronegatiivsuse erinevuse suurenedes muutub kovalentne side veelgi polariseeruvaks, muutudes nõrgalt sidemeks tugev.
Bibliograafia
• Märkmed õppetoolilt, Üldkeemia I, UNMdP, Faculty of inseneritöö, 2019.
Oktetireegli teemad