100 esimerkkiä kemiallisista alkuaineista
Sekalaista / / November 13, 2021
kemialliset alkuaineet ovat tietyntyyppisiä asioita, joita ei missään menettelyssä tai kemiallinen reaktio ne voidaan pelkistää tai hajottaa muiksi yksinkertaisemmiksi elementeiksi. Tästä syystä voidaan sanoa, että elementti on kaikki asia tehnyt atomeja samaan ja ainutlaatuiseen luokkaan, eli atomeihin, joilla on sama atomiluku (sama määrä protoneja), vaikka niillä on erilainen atomimassa. Esimerkiksi: rikki, boori, kromi, tina.
Kemiallisen alkuaineen ensimmäisen määritelmän otti käyttöön Lavoisier että Traité Élémentaire de Chimie, vuonna 1789. Jo 1700-luvulla Lavoisier jakoi yksinkertaiset aineet neljään ryhmään:
Elementtien jaksollinen taulukko
Nykyään he tuntevat toisensa 118 kemiallista alkuaineita. Ne kaikki on koottu, luokiteltu ja järjestetty monien ominaisuuksiensa mukaan graafiseen kaavioon, joka tunnetaan nimellä alkuaineiden jaksollinen taulukko, jonka alun perin loi venäläinen kemisti Dimitri Mendelejev vuonna 1869. Jaksotaulukko koostuu 18 ryhmästä (sarakkeet) ja 7 jaksosta (rivi), joissa kemialliset alkuaineet sijaitsevat.
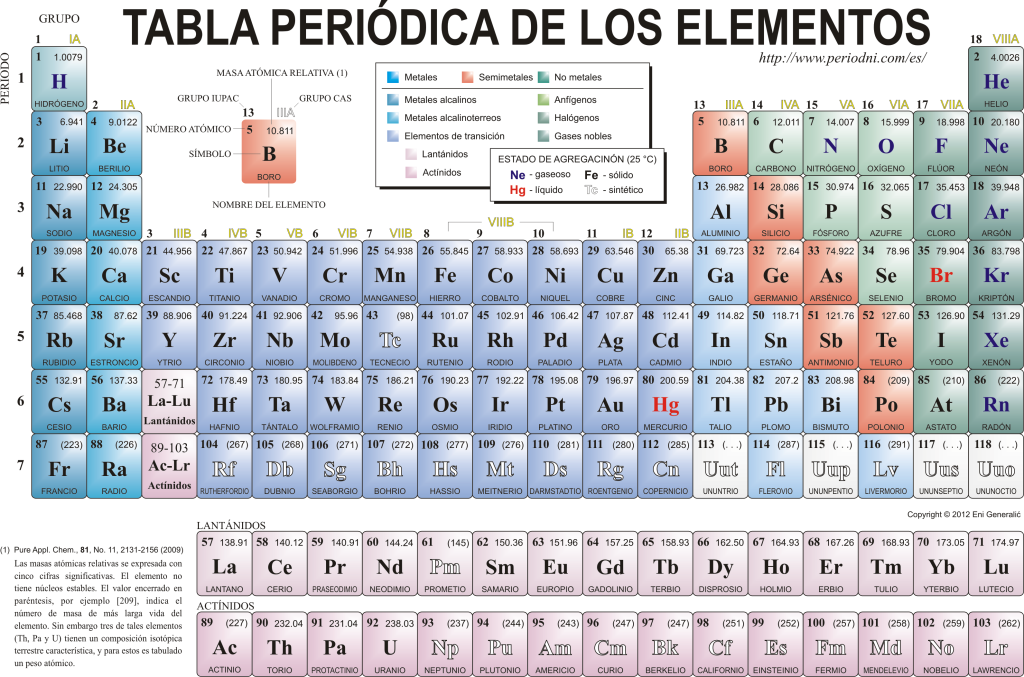
pääryhmät taulukosta löytyvät seuraavat:
Alkalimetallit (ryhmä 1), maa-alkalimetallit (ryhmä 2), skandiumperhe, johon kuuluvat maametallit ja aktinidit (ryhmä 3), titaaniperhe (Ryhmä 4), vanadiumperhe (ryhmä 5), kromiperhe (ryhmä 6), mangaaniperhe (ryhmä 7), rautaperhe (ryhmä 8), kobolttiperhe (ryhmä) 9), nikkeliperhe (ryhmä 10), kupariperhe (ryhmä 11), sinkkiperhe (ryhmä 12), maa-elementit (ryhmä 13), Hiilen, joka on elämän pohja maapallolla (ryhmä 14), typpeä muodostavien alkuaineiden (ryhmä 15), amfigeneettisten alkuaineiden, joukossa happi, hengitys n elävät olennot (Ryhmä 16), halogeenielementit (ryhmä 17) ja jalokaasut (ryhmä 18).
Monilla näistä elementeistä on stabiilit tai radioaktiiviset isotoopiteli samalla kemiallisella alkuaineella, esimerkiksi vedyllä (H), voi olla useita isotooppeja (1H, 2H, 3H). Tämä tarkoittaa, että jokaisella isotooppiatomilla on sama määrä protoneja (mikä tarkoittaa, että se kuuluu samaan kemialliseen elementtiin) ja eri määrä neutroneja.
Jotkut isotoopit eivät ole stabiileja (radioaktiivisia), hajota tietyssä ajassa päästämällä tiettyjä hiukkasia (muun muassa neutroneja, fotoneja, alfa-hiukkasia) ja muodostamalla muita stabiileja tai radioaktiivisia isotooppeja. Kemiallisilla alkuaineilla on ominaisuuksia, kuten piste kiehuva ja fuusio, elektronegatiivisuus, tiheys ja ionisäde mm. Nämä ominaisuudet ovat tärkeitä, koska niiden avulla voimme ennustaa sen käyttäytymistä, reaktiivisuutta jne.
Kuinka jaksollisen järjestelmän elementit esitetään?
Jokaiselle kemialliselle alkuaineelle on tunnusomaista Jaksollinen järjestelmä käyttäen tiettyä symbologiaa. Ensinnäkin jokaisen neliön keskellä sen universaali symboli, joka koostuu yhdestä tai kahdesta kirjaimet (sopimuksen mukaan, jos kirjaimia on kaksi, ensimmäinen kirjoitetaan isoilla ja seuraava pienillä).
Ylä- ja vasemmalla puolella näkyy pieni kirjasintyyppi su atomiluku, joka osoittaa tämän elementin protonimäärän. Elementtisymbolin alapuolella näkyy sen nimi ja yläpuolella vasemmalla sen nimi. atomimassa suhteellinen. Lisäksi väri, jossa elementtisymboli on edustettu, tarkoittaa sen aggregaatiotilaa (kussakin jaksollisessa taulukossa käytetyn esityksen mukaan).
Eri elementit läsnä atomisäteet muuttujia ja, kun protonien määrä ytimessä kasvaa, sitä suurempi vetovoima, jota ydin aiheuttaa elektronille, niin atomisäde pyrkii pienenemään. Kun atomisäde on pieni, pilven uloimman tason elektronit ovat hyvin houkutelleet ytimeen, joten ne eivät anna periksi. Päinvastoin tapahtuu elementeillä, joilla on suuri atomisäde: ne luopuvat helposti ulkoisista elektroneistaan.
Siksi atomisäde kasvaa ylhäältä alas, kun käymme läpi jaksollisen taulukon ryhmät, ja pienenee vasemmalta oikealle, kun käymme läpi niiden jaksot.
Esimerkkejä kemiallisista alkuaineista
| Kemiallinen alkuaine | Symboli |
| Actinium | Ac |
| Alumiini | Kohteeseen |
| Americium | OLEN |
| Antimoni | Sb |
| Argon | Ar |
| Arseeni | Ässä |
| Astat | Klo |
| Rikki | S |
| Barium | Ba |
| Beryllium | Olla |
| Berkelium | Bk |
| Vismutti | Bi |
| Bohrio | Bh |
| Boori | B |
| Bromi | Br |
| Kadmium | CD |
| Kalsium | AC |
| Californium | Vrt |
| Hiili | C |
| Cerium | EY |
| Cesium | Cs |
| Kloori | Cl |
| Koboltti | Co |
| Kupari | Cu |
| Kromi | Kr |
| Kurium | Cm |
| Darmstadio | Ds |
| Dysprosium | Dy |
| Dubnium | Db |
| Einsteinium | se on |
| Erbium | Er |
| Scandium | Sc |
| Tina | Sn |
| Strontium | Herra |
| Europium | Eu |
| Fermium | Fm |
| Fluori | F |
| Ottelu | P |
| Francius | Fr |
| Gadolinium | Gd |
| Gallium | Ga |
| Germanium | Ge |
| Hafnium | Hf |
| Hassio | Hs |
| Helium | minulla on |
| Vety | H |
| Rauta | Usko |
| Holmium | Ho |
| intialainen | Sisään |
| Jodi | Minä |
| Iridium | Mennä |
| Yterterium | Yb |
| Yttrium | Y |
| Krypton | Kr |
| Lanthanum | |
| Lawrencio | Lr |
| Litium | Li |
| Lutetium | Ma |
| Magnesium | Mg |
| Mangaani | Mn |
| Meitnerius | Mt |
| Mendelevium | Md |
| Elohopea | Hg |
| Molybdeeni | Mo |
| Neodyymi | Na |
| Neon | Ne |
| Neptunium | Np |
| Niobium | Huom |
| Nikkeli | Ei kumpikaan |
| Typpi | N |
| Nobelio | Ei |
| Kulta | Au |
| Osmium | Sinä |
| Happi | TAI |
| Palladium | P.S |
| Hopea | Ag |
| Platina | Pt |
| Johtaa | Pb |
| Plutonium | Pu |
| Polonium | Po |
| Kalium | K |
| Praseodyymi | PR |
| Lupaus | P.m |
| Protactinium | Pa |
| Radio | Ra |
| Radon | Rn |
| Renium | Re |
| Rodiumia | Rh |
| Rubidium | Rb |
| Rutiini | Ru |
| Rutherfordio | Rf |
| Samarium | Ye |
| Seaborgio | Sg |
| Seleeni | Tiedän |
| Piin | Joo |
| Natrium | Na |
| Tallium | Tl |
| Tantaali | Ta |
| Teknetium | Tc |
| Telluurium | Tee |
| Terbium | Tb |
| Titaani | Sinä |
| Torium | Th |
| Thulium | Tm |
| Kopernikus | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoktium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Uraani | TAI |
| Vanadiini | V |
| Volframi | W |
| Xenon | Xe |
| Sinkki | Zn |
| Zirkonium | Zr |

Seuraa:


